
| A.HCl的水溶液是强酸,HF的水溶液也是强酸 |
| B.CH4是正四面体结构,SiH4也是正四面体结构 |
| C.O2与Cu反应生成CuO,S与Cu反应生成CuS |
| D.苯与酸性高锰酸钾溶液不反应,甲苯与酸性高锰酸钾溶液也不反应 |
科目:高中化学 来源:昌平区二模 题型:填空题
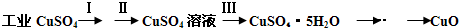
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源:广州一模 题型:问答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分 洗涤后,取滤渣于试管中,______ | 说明悬浊液中混______,有Cu4( 0H)6S04. |
| 步骤2:另取少量悬浊液于试管中,______ | ______, 说明悬浊液中混有Cu( 0H) 2. |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式:___________________________。
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式:___________________________。
(3)新制的铜试剂[Cu(OH)2]与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:
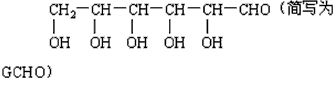
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl | B.Na2CO3 | C.KNO3 | D.MgCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在空气中燃烧 |
| B.加适量稀硫酸、微热、过滤 |
| C.加适量水、微热、过滤 |
| D.加适量稀硫酸、微热、蒸发 |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:福建省期中题 题型:单选题
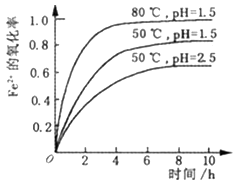
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com