
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是
A.某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨
B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C.高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应
D.人造纤维,合成纤维和光导纤维都是有机高分子化合物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)下列各组物质:①金刚石和C60 ②H、D和T ③乙烷和已烷 ④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式: 。
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
vL Fe2(SO4)3溶液中含有a克SO42-,取此溶液0.5vL,用水稀释至2vL,则稀释后溶液中Fe3+的物质的量的浓度为
A. mol/L B.
mol/L B.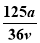 mol/L
mol/L
C.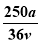 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
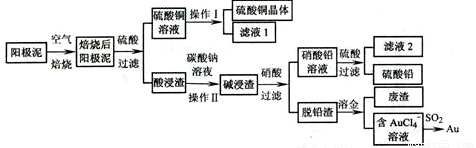
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为_____________过滤、洗涤、干燥,操作II的名称是 。
(4)写出用SO2还原AuCl4一的离子方程式______________________。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法_____________________。
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH-===SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+===2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中,一定能大量共存的是
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
B.在0.1 mol·L-1Na2CO3溶液中:A13+、Na+、NO3-、C1-
C.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
D.在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016届山西省晋中市四校高三上学期期中联考化学试卷(解析版) 题型:选择题
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气为0.16 mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl): n(NaClO): n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中测试化学试卷(解析版) 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的 pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 , c(OH-)-c(HA)=________mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:填空题
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40 mg / kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成___________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这里碘指的是___________(填化学式);,其中碘元素的化合价为___________。
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易___________。
(4)辨别真假碘盐时,可将盐溶于水,加入KI溶液和少量白醋,再加淀粉溶液。以下判断正确的是( )
A.如显出绿色,是真碘盐 B.如显出红色,是真碘盐
C.如显出蓝色,是真碘盐 D.如显出黄色,是真碘盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com