
| A.KI | B.浓氨水 | C.冰醋酸 | D.热水 |
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:不详 题型:单选题
A.H2O的电子式为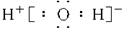 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CxHy(l)+(x+y/4)O2(g)=xCO2(g)+y/2H2O(l) ΔH=(-Q+1366.8) kJmol-1 |
| B.CxHy(l)+(x+y/4)O2=xCO2(g)+y/2H2O(l) ΔH=-9Q/10 kJmol-1 |
| C.CxHy(l)+(x+y/4)O2(g)=xCO2(g)+y/2H2O(l) ΔH=-9Q/110 kJmol-1 |
| D.CxHy(l)+(x+y/4)O2(g)=xCO2(g)+y/2H2O(l)ΔH=(-10Q/9+151.9) kJmol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可能等于7 | B.一定<7 | C.一定>7 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
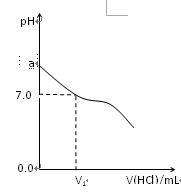
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。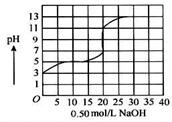
A.该弱酸在滴定前 的浓度是0.15 mol/L 的浓度是0.15 mol/L |
| B.该弱酸稀释10倍后pH为4 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定过程为求滴定终点,最合适的指示剂是甲基橙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某强碱性溶液中加入足量盐酸产生无色无味且能使澄清的石灰水变浑浊的气体,则该溶液中一定含有大量CO32- |
B.煮沸MgCO3悬浊液,得到M g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2 g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2的溶解度 |
| C.在铁器上电镀铜的实验过程中,电镀液(CuSO4溶液)的pH逐渐升高 |
D.欲制备F(OH)3胶体,向盛有沸水的 烧杯中滴加FeCl3饱和溶液并长时间煮沸 烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com