
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是
A. 乙酸乙酯和水,酒精和水,植物油和水 B. 四氯化碳和水,溴苯和苯,硝基苯和水
C. 甘油和水,乙酸和水,乙酸和乙醇 D. 汽油和水,苯和水,已烷和水
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】碳、氮广泛地分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g)![]() Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
(2)某研究小组现将三组CO(g) 与H2O(g) 的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到下表数据:
CO2(g) + H2(g),得到下表数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | |
① 实验1中,前5min的反应速率v(CO2) = 。
② 下列能判断实验2已经达到平衡状态的是 (填序号)。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③ 若实验2的容器是绝热的密闭容器,实验测得H2O(g) 的转化率ω(H2O)随时间变化的示意图如图1所示,b点v正 v逆(填“<”、“=”或 “>”),t3~t4时刻,H2O(g) 的转化率ω(H2O)降低的原因是 。

(3)利用CO与H2可直接合成甲醇,上图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol·L-1的CuSO4溶液,当电池消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在溶液中的反应可用H++OH-===H2O表示的是( )
A.氢氧化钡和硫酸
B.氢氧化铁和盐酸
C.醋酸和氢氧化钠
D.硫酸氢钠和氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列除杂操作可行的是( )
A. 通过浓硫酸除去HCl中的H2O B. 通过灼热的CuO除去H2中的CO
C. 通过灼热的镁粉除去N2中的O2 D. 通过水除去CO中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是 ( )
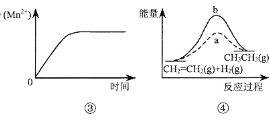
A.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
B.图④中a、b曲线分别表示反应CH2=CH2 (g)+ H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
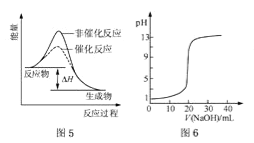
C.图5表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图6表示0.1000mol L-1NaOH溶液滴定20.00mL0.1000mol L-1CH3COOH溶液所得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反虑结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则下列说法错误的是:
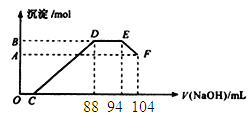
A. 铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4
B. 原硝酸溶液中含硝酸的物质的量为0.5mol
C. B与A的差值为0.05 mol
D. 反应结束后的溶液仍有硝酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德埃特尔在哈伯研究所证实了N2与H2在固体催化剂表面合成氨的反应过程。示意图如下(![]()
![]()
![]() 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
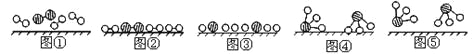
图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,则图③表示 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。酸性KMnO4溶液与NaNO2反应的离子方程式是:MnO4-+NO2-+X![]() Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com