
分析 ①根据n=$\frac{m}{M}$计算出硫酸铜的物质的量,然后可计算出该溶液中Cu2+和SO42-的总物质的量;
②根据溶液的质量和密度计算溶液的体积,物质的量除以体积可得物质的量浓度;
②根据溶液稀释前后溶质的物质的量不变计算体积.
解答 解:①8gCuSO4的物质的量为:$\frac{8g}{160g/mol}$=0.050mol,0.05mol硫酸铜中含有Cu2+和SO42-的总物质的量为:0.050mol+0.050mol=0.10mol,
答:该溶液中Cu2+和SO42-的总物质的量为0.10mol;
②溶液的体积为:$\frac{32g+8g}{1210g/L}$=0.033L,
该溶液中CuSO4的物质的量浓度为:$\frac{0.050mol}{0.033L}$=1.51 mol/L,
答:该溶液中CuSO4的物质的量浓度为1.51 mol/L;
(3)取出溶液中含溶质硫酸铜的物质的量为:1.51 mol/•L×0.02L=0.0302mol,
则稀释后溶液的体积为:$\frac{0.0302mol}{1.00mol/L}$=0.0302L=30.2 mL,
答:稀释后溶液的体积是30mL.
点评 本题主要考查物质的量浓度的有关计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,注意溶液稀释前后溶质的物质的量不变,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
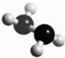 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 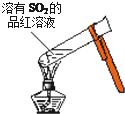 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 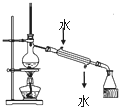 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com