
分析 (1)根据c=$\frac{1000ρω}{M}$计算公式变形计算NaOH的质量分数;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,根据c=nV计算NaOH物质的量,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO),据此计算溶液中n(NaCl),溶液中n(Cl-)=n(NaCl);
(3)根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)=n(NaOH),根据电子转移守恒计算氯气与氢氧化钠反应生成NaCl,进而计算HCl与氢氧化钠反应生成的NaCl,再根据H原子守恒计算n(H2),据此解答.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,NaOH溶液的质量分数为$\frac{3×40}{1000×1.12}$=10.7%,故答案为:10.7%;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,溶液中n(NaOH)=n(NaCl)+n(NaClO)=0.1L×3mol/L=0.3mol,故溶液中n(NaCl)=0.3mol-0.06mol=0.24mol,溶液中n(Cl-)=n(NaCl)=0.24mol,
故答案为:0.24;
(3)故HCl与NaOH反应生成的NaCl的物质的量为0.3mol-0.06mol×2=0.18mol,故n(HCl)=0.18mol,故n(H2)=0.09mol,氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH)=0.3mol,所以n(Cl2)=0.15mol,故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.09mol=5:3,故答案为:5:3.
点评 本题考查混合物的有关计算、溶液浓度有关计算,难度中等,清楚发生的反应是关键,注意利用守恒法进行计算,可以简化计算.


科目:高中化学 来源: 题型:选择题
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 若存在简单阴离子R2-,则R一定位于ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ;它的一种同素异形体是O3.(写化学式)
;它的一种同素异形体是O3.(写化学式)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它是一种共价化合物 | B. | 在加热时此化合物可以分解 | ||
| C. | 这种化合物不能跟碱发生反应 | D. | 该化合物可以由PH3跟HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在氯气中燃烧,产生白烟 | |
| B. | 将氯水滴入紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用pH试纸测得0.1mol•L-1硫酸铝溶液显中性 | |
| D. | 向新切土豆上滴加碘水,土豆片上显示蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
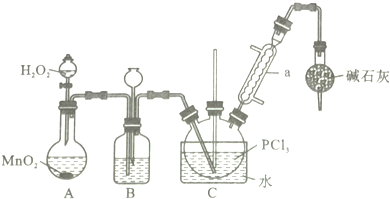
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com