
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
 请回答:
请回答:
(1) A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是________。
a.溴水 b.新制的Cu(OH)2悬浊液
c.酸性KMnO4溶液 d.银氨溶液
(2)反应⑥的化学方程式为______________________________。
(3) G是E的同系物且相对分子质量比E大28。G有多种同分异构体,其中符合下列条件的同分异构体有________种,其中核磁共振氢谱有5组峰,且面积比为6∶1∶2∶2∶1的结构简式为________。
①能与Na2CO3溶液反应 ②分子中含有两个—CH3
【答案】 b 
 13
13 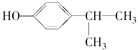
【解析】 催化氧化生成A,A催化氧化生成
催化氧化生成A,A催化氧化生成 ,则A为
,则A为 ;
; 发生反应生成B,B和E通过反应生成芳香酯类物质F(C11H12O2),则E为含有7个C的醇,只能为
发生反应生成B,B和E通过反应生成芳香酯类物质F(C11H12O2),则E为含有7个C的醇,只能为![]() ,故C为
,故C为![]() ,C与氯气在光照条件下发生取代反应生成D,则D为
,C与氯气在光照条件下发生取代反应生成D,则D为![]() 。
。
(1)A为 、B为
、B为![]() 、E为
、E为![]() ,溴水与A、B的反应现象相同;酸性高锰酸钾都能够与三种有机物反应;溴的四氯化碳溶液都能够与A、B反应;只有b.新制的Cu(OH)2浊液能够鉴别:与A能够发生氧化还原反应生成砖红色沉淀、与B发生正反应,浊液变澄清、与E不反应,故答案为:b;(2)反应⑥为羧酸和醇的酯化反应,所以该反应的化学方程式为
,溴水与A、B的反应现象相同;酸性高锰酸钾都能够与三种有机物反应;溴的四氯化碳溶液都能够与A、B反应;只有b.新制的Cu(OH)2浊液能够鉴别:与A能够发生氧化还原反应生成砖红色沉淀、与B发生正反应,浊液变澄清、与E不反应,故答案为:b;(2)反应⑥为羧酸和醇的酯化反应,所以该反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(3)E为![]() ,G是E的同系物且相对分子质量比E大28,说明G分子中含有1个苯环、醇羟基,且侧链含有3个C;①能与Na2CO3溶液反应,有机物分子中含有酚羟基;②分子中含有两个一CH3,满足以上条件的有机物的苯环侧链为:-OH、-CH3、-CH2CH3或CH(CH3)2、-OH;取代基为-OH、-CH3、-CH2CH3时可能情况为:①都处于邻位,有3种结构;②都处于间位,有1种结构;③-OH、-CH3相邻,-CH2CH3在间位,有2种结构;④-CH3、-CH2CH3相邻,-OH在间位,有2种结构;⑤-OH、-CH2CH3相邻,-CH3在间位,有2种结构,总共有10种结构;当取代基为CH(CH3)2、-OH时,存在邻、间、对3种同分异构体,所以总共含有13种满足条件的同分异构体;其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式中,存在5种等效H原子,6为甲基、其中1
,G是E的同系物且相对分子质量比E大28,说明G分子中含有1个苯环、醇羟基,且侧链含有3个C;①能与Na2CO3溶液反应,有机物分子中含有酚羟基;②分子中含有两个一CH3,满足以上条件的有机物的苯环侧链为:-OH、-CH3、-CH2CH3或CH(CH3)2、-OH;取代基为-OH、-CH3、-CH2CH3时可能情况为:①都处于邻位,有3种结构;②都处于间位,有1种结构;③-OH、-CH3相邻,-CH2CH3在间位,有2种结构;④-CH3、-CH2CH3相邻,-OH在间位,有2种结构;⑤-OH、-CH2CH3相邻,-CH3在间位,有2种结构,总共有10种结构;当取代基为CH(CH3)2、-OH时,存在邻、间、对3种同分异构体,所以总共含有13种满足条件的同分异构体;其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式中,存在5种等效H原子,6为甲基、其中1 ,故答案为:13;
,故答案为:13; 。
。


科目:高中化学 来源: 题型:
【题目】为确定下列置于空气中的物质是否变质,所选试剂(括号内的物质)不能达到目的是( )
A.氯水(AgNO3溶液)
B.NaOH溶液[Ba(OH)2溶液]
C.FeSO4溶液(KSCN溶液)
D.KI溶液(淀粉溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如右图,电池总反应为:CH4+2O2=CO2+2H2O。下列有关说法正确的是

A. 电子由a极流出经过负载流向b极
B. 电解质溶液中H+移向a极
C. 每转移1mole-,消耗1.6gCH4
D. b极上的电极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
①工业上制造光导纤维的基本原料是 (填化学式)。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
③在生铁和钢这2种金属材料中,含碳量较高的是 。
④铁红的主要成分的化学式是___________。
⑤明矾在生活中可用作____________剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2FeO4可通过电解法制备,装置见下图,下列说法正确的是

A. Pt周围的pH降低
B. 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA
C. 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O
D. 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L 二元酸H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒物质的量变化如右图。下列叙述正确的是

A. 从图象中可知H2A为强酸
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小
顺序为c(Na+)>c(HA-)> c(H+) >c( A2-) >c(OH-)
C. 当V(NaOH) =20 mL时混合溶液的pH值大于7
D. 当V(NaOH) =40 mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有___________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2:3Br2+ 6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是________ mol。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是_____________ mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是____________ g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是__________(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com