
����Ŀ�������仯���������������ϵ���С������������գ�
��1������N��H ����Ԫ����ɣ�������������ƽ������µ���Է�������Ϊ32��������N��Hԭ�ӵĸ�����Ϊ1��2���µķ���ʽΪ_____________��16g �·����������ĵ�ԭ�������״����_______L N2�������ĵ�ԭ������ȡ�
��2��ʵ���ҳ�����ͼ��ʾװ����ȡ���ռ�������

��ʵ������ȡ������Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ͼ�з������ռ�������װ�ÿ�ѡ��_________________������ĸ��ţ���
��β������װ����ʹ�õ���©����������_________________________________��
��3����ʢ��һ����Ũ������Թ��м���6.4g��ͭƬ������Ӧ����ش��������⣺
�ٿ�ʼ�Σ���Ӧ�Ļ�ѧ����ʽΪ____________________________________�����÷�Ӧ��������״��������2.24L����Ӧ�����б���ԭ��HNO3�����ʵ���Ϊ_______��
�ڷ�Ӧ������ͭƬ��ʣ�࣬�ټ�������20%��ϡ���ᣬ��ʱͭƬ���������ݲ�������Ӧ�����ӷ���ʽΪ____________________________________________________��
���𰸡� N2H4 11.2 Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3�� C ��ֹ�ձ��е�ˮ���� Cu+4HNO3(Ũ)=Cu(NO)3+2NO2��+2H2O 0.1mol 3Cu+8H++2NO3��=3Cu2++2NO��+4H2O
CaCl2+2H2O+2NH3�� C ��ֹ�ձ��е�ˮ���� Cu+4HNO3(Ũ)=Cu(NO)3+2NO2��+2H2O 0.1mol 3Cu+8H++2NO3��=3Cu2++2NO��+4H2O
����������1���µķ�����N��Hԭ�ӵĸ�����Ϊ1:2�����µķ���ʽΪ(NH2)n����Է�������Ϊ32����16n=32����֮��n=2�������ʽΪ��N2H4��16g�·����к���ԭ���� ![]() =1mol��������0.5mol N2����ԭ���������N2���Ϊ0.5��22.4=11.2L��
=1mol��������0.5mol N2����ԭ���������N2���Ϊ0.5��22.4=11.2L��
�ʴ�Ϊ��N2H4��11.2��
��2������κͼ��ܷ�Ӧ���ɰ�����ʵ�������������ƺ��Ȼ���ڼ��������·�Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ��Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����
�ʴ�Ϊ��Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����
�ڰ�����������ˮ���ܶȱȿ���С�������ռ�������ѡ�������ſ����������ݽ�������Ӧ����Cװ�ã��ʴ�Ϊ��C��
�۰�����������ˮ������©���л������ã������ܳ�ֱ��������Ӷ���ֹ������
�ʴ�Ϊ����ֹ�ձ��е�ˮ������
��2��ͭ��Ũ���ᷴӦ��һ��ʼ�к���ɫ���弴NO2��������Һ��Ϊ��ɫ����ѧ����ʽΪ��Cu+4HNO3(Ũ)=Cu(NO)3+2NO2��+2H2O�����ݷ���ʽ��֪��ÿ����1molNO2,��1molHNO3����ԭ���÷�Ӧ���������������2.24L��������0.1molNO2����ԭ��HNO3�����ʵ���Ϊ0.1mol��
�ʴ�Ϊ��Cu+4HNO3(Ũ)=Cu(NO)3+2NO2��+2H2O��0.1mol��
��3��ͭ�����ᷴӦ����������ͭ����Һ�е�H+������֮������Ȼ��NO3-ʣ������ʱ��������ṩ��H+����Һ�൱��ϡ������Һ�����Իᷢ��ͭƬ��ϡ����ķ�Ӧ�����ӷ���ʽΪ��3Cu+8H++2NO3-=3Cu2++4H2O+2NO����
�ʴ�Ϊ��3Cu+8H++2NO3��=3Cu2++2NO��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ��е�λ������ͼ��ʾ����Yԭ�ӵ������������Ǵ�����������2��������˵������ȷ���ǣ� �� ![]()
A.�⻯���ȶ��ԣ�X��Y
B.����������Ӧ��ˮ��������ԣ�W��Y
C.4��Ԫ�صĵ����У�W���ʵ��ۡ��е����
D.�����W���ʾ���Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����1���õ�����CuSO4��5H2O������0.200mol/L CuSO4��Һ240mL������Ҫ�IJ�������Ϊ���ձ�����Ͳ��________________________��Ҫ��ȫ����Ӧ��ȡ����������Ϊ____________��
��2�����в���ʹ����CuSO4��ҺŨ��ƫ�͵���____________��
A���۲�̶���ʱ����
B���۲�̶���ʱ����
C�����ݺ�ת����ƿ���Σ�����Һ����͵���ڱ��ߣ��ٲ�����ˮ������
D��������Һǰ������ƿ������������ˮ
��������1���õ����ű���÷�Ӧ�ĵ���ת�Ʒ������Ŀ�����ش�������⣺
KClO4+8HCl(Ũ)=KCl+4Cl2��+4H2O____________���������뻹ԭ�������ʵ���֮��Ϊ____________��
��2����ƽ��ѧ����ʽ������ѧ���������ڿհ״���
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
���������뻹ԭ��������ʵ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���H����ȷ��ʾ���ʵ�ȼ���ȵ��ǣ� ��
A.CO��g��+ ![]() O2��g���TCO2��g������H=��283.0 kJ/mol
O2��g���TCO2��g������H=��283.0 kJ/mol
B.C��s��+ ![]() O2��g���TCO��g������H=��110.5 kJ/mol
O2��g���TCO��g������H=��110.5 kJ/mol
C.H2��g��+ ![]() O2��g���TH2O��g������H=��241.8 kJ/mol
O2��g���TH2O��g������H=��241.8 kJ/mol
D.2C8H18��l��+25O2��g���T16CO2��g��+18H2O��l������H=��11036 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ȳ�ͬѹǿ��P1��P2���£����淴Ӧ2X��g��2Y��g��+Z��g���У�������Z�ڷ�Ӧ������е����������Z%���뷴Ӧʱ�䣨t���Ĺ�ϵ������ͼʾ����ȷ���ǣ� ��
A.
B.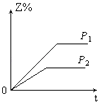
C.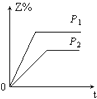
D.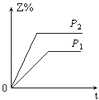
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ���Mg2+��Ba2+��Cl-��CO32-��Cu2+��Fe3+�е�һ�ֻ������ӡ�Ϊȷ����ɷ֣���������ʵ�飺
ʵ��1��ȡ10mL��ɫ��Һ���μӹ���ϡ��������������
ʵ��2����ȡ10mL��ɫ��Һ������������Na2SO4��Һ���а�ɫ�������ɡ�
ʵ��3��ȡʵ��1�����Һ����ƿ�У�����ƿ����μ���NaOH��Һ���μӹ����в������������������NaOH��Һ������Ĺ�ϵ����ͼ��ʾ��

�ش��������⣺
��1��ԭ��Һ�в����ڵ�������__________�����ڵ�������________________��
��2��ʵ��3�У�ͼ����OA�η�Ӧ�����ӷ���ʽΪ____________________________��
��3������ͼ�����ԭ��Һ��Mg2+�����ʵ���Ũ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֮���ÿ��ת���У�����ͨ��һ��ʵ�ֵ��ǣ� ��
��Fe��FeCl2��Fe(OH)2�� Fe(OH)3
��Na��Na2O��Na2CO3��NaHCO3��NaOH
��Mg��MgCl2��Mg(OH)2
��Al��Al2O3��Al(OH)3
��Al��NaAlO2��Na2CO3
A. �ڢۢ� B. �٢ۢܢ� C. �٢ڢۢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ع���ʱ��ӦΪ��4VB2+11O2=4B2O3+2V2O5 �� �������øõ��Ϊ��Դ���ö��Ե缫��ⱥ�ͷջ�����Һ��װ����ͼ�������·��ͨ��0.04mol����ʱ����װ������Һ�����Ϊ400mL��������˵����ȷ���ǣ� �� 
A.���·�е�����a�缫����b�缫
B.�缫��������������Ϊ4.48L
C.��װ������Һ��pHΪ13
D.VB2�缫�����ĵ缫��ӦΪ��VB2+11H2O��22e��=VB2+2B2O3+22H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���һ�����ŵ���Ԫ�ش���������Ԫ�ش�������δ������������������Ԫ�ش�������Ϊ�ɶ���˹��ѧ�����û����������ɹ��ϳɵ�119�ų���Ԫ�ذ��ź����ķ���(����)
A. �ڰ����ڵڢ�A��
B. �������ڵڢ�A��
C. ��������0��
D. �������ڵڢ�A��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com