
(14分)
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
| | H2 | O2 | F2 | O-H | O-F | H-F |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
科目:高中化学 来源: 题型:
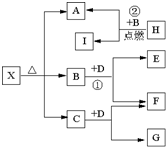 Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 |
| 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
|
| H2 | O2 | F2 | O-H | O-F | H-F |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为 kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式: 。
(4)1986年,化学家KarlChriste首次用2K2MnF6 +4SbF5 === 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从 价变为 价,若反应中生成标准状况下11.2 L的F2,则有 mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:填空题
(14分)
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
|
|
H2 |
O2 |
F2 |
O-H |
O-F |
H-F |
|
E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为 kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式: 。
(4)1986年,化学家Karl Christe首次用2K2MnF6 + 4SbF5 === 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从 价变为 价,若反应中生成标准状况下11.2 L的F2,则有 mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
| H2 | O2 | F2 | O-H | O-F | H-F | |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com