
把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中错误的是( )
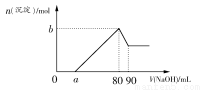
A.盐酸的体积为80 mL
B.a的取值范围为0<a<50
C.n(Mg2+)<0.025 mol
D.当a值为30时,b值为0.01
D
【解析】从开始到沉淀量最大的过程中,涉及的反应有Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑、H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,此时消耗的NaOH的物质的量等于HCl的总物质的量,A正确;80 mL~90 mL的NaOH溶液用于溶解Al(OH)3:Al(OH)3+OH-=AlO2-+2H2O,故形成Al(OH)3沉淀消耗NaOH溶液的体积是30 mL,所以a<50,B项正确;从题图来看,若a=0,则Mg2+的最大值是0.025 mol,而a≠0,故C正确;当a为30时,得到Mg(OH)2、Al(OH)3沉淀的物质的量均为0.01 mol,共0.02 mol,D项不正确。


科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1 mol A、3 mol B发生可逆反应:A(g)+3B(g)  2C(g)+D(s),下列说法正确的是( )
2C(g)+D(s),下列说法正确的是( )
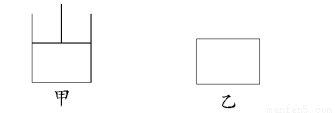
A.当乙中混合气体总质量不再变化时即达到化学平衡
B.达平衡时用A表示反应速率时,v(甲)<v(乙)
C.由于容器甲的容积在不断变化,故从反应开始到平衡所需时间比容器乙要长
D.达到平衡时,甲所需时间短,但两容器中A的转化率相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层电子结构都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是( )
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.1 mol NH5中含有5 mol N—H键
D.将固体A投入少量水中,可生成H2和NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
在下图所示转化关系中,A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体。且各种物质所含元素除H、O外,其余均为第三周期元素。
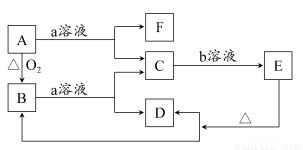
请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则B的化学式为________。
(2)若实现C→E转化所需的b溶液不能使用“过量的盐酸”,只能使用“少量的盐酸”,则C的溶液显________(填“酸”“碱”或“中”)性;A和a溶液反应,若产生标准状态下3.36 L的F气体,转移的电子数目为________。
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则E的化学式为________;反应B+a→C+D的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
将一定质量的Mg、Al合金投入2.0 mol/L、250 mL的稀硫酸中,金属全部溶解。然后向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
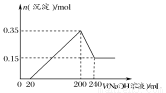
A.当加入NaOH溶液的体积为20 mL时,溶液的pH等于7
B.当加入NaOH溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.生成的H2在标准状况下的体积为11.2 L
D.所加NaOH溶液的物质的量浓度为5.0 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.硅材料广泛应用光纤通讯
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:填空题
北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题1化学家眼中的物质世界练习卷(解析版) 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式:________。
(2)反应中硝酸体现了________、________。
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是________ mol。
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4 g,恰好与100 mL 1.4 mol·L-1的硝酸溶液完全反应,则该样品的纯度为________。
(5)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是( )
A.食用的蛋白质、淀粉和脂肪都可发生水解反应
B.海轮外壳上镶入铅块,可减缓船体的腐蚀速率
C.大力开发和应用氢能源有利于实现“低碳经济”
D.工业上,用电解熔融MgCl2的方法制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com