
分析 (1)氨气易溶于水,二氧化碳能溶于水,先通入氨气回增大二氧化碳的吸收;
(2)用滴定法测定其中NaHCO3的含量,称取一定质量样品,配成250mL溶液,取出25.00mL 用1000mol/L的盐酸滴定,结合配制250ml溶液步骤和地点实验步骤选择定量仪器;盐酸滴定碳酸氢钠溶液生成二氧化碳、氯化钠和水,恰好完全反应溶液略显酸性,选择甲基橙;
(3)依据样品质量和钠元素守恒设计实验测定,样品加入足量盐酸反应生成氯化钠溶液,加热蒸干至恒重称量固体质量,列式计算;相对误差=实验结果-准确值,则若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高
解答 解:(1)氨气易溶于水,二氧化碳能溶于水,向氨化的水中通入二氧化碳气体析出碳酸氢钠,制得NH4HCO3,所以通入水中的气体是为氨气,后通入的气体为二氧化碳,将CO2、NH3通入H2O中制得NH4HCO3,析出NH4HCO3的反应有两步,第二步反应的离子方程式为:CO2+2NH4++CO32-+H2O=2NH4HCO3↓,
故答案为:氨气,CO2+2NH4++CO32-+H2O=2NH4HCO3↓;
(2)步骤②生成了含少量NaCl的小苏打,现用滴定法测定其中NaHCO3的含量.过程为:称取一定质量样品,配成250mL溶液,取出25.00mL 用1000mol/L的盐酸滴定.实验中所写的定量仪器除滴定管外,还有精确度较高的电子天平、250ml容量瓶,
碳酸氢钠溶液的pH本来就接近8.2,与酚酞变色的pH接近,变色时的pH和反应终点的pH不好判断,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,使用甲基橙容易判断终点,因此使用甲基橙的误差小,
故答案为:电子天平、250mL容量瓶;甲基橙;
(3)步骤②生成了含少量NaHCO3的纯碱.若用重量法(限用试剂:稀盐酸)测定其中Na2CO3含量,实验方案为:称取一定质量的该样品,加入足量稀盐酸,充分反应后,加热蒸干至恒重,称量所得固体氯化钠的质量,若该样品中NaHCO3含量的准确值为99.5%,而上述实验结果为97.6%,则测定的相对误差为97.6%-99.5%=-1.9%,可能造成该实验误差的原因是蒸发过程中有少量晶体溅出,
故答案为:称取一定质量的该样品,加入足量稀盐酸,充分反应后,加热蒸干至恒重,称量所得固体氯化钠的质量;-1.9%;蒸发过程中有少量晶体溅出;
点评 本题考查了物质组成的实验测定、实验方案设计、实验基本操作,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验原理以及物质的性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
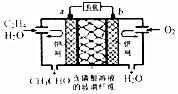 中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该电池电极a为正极,b为负极 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 负极反应式为:CH2═CH2-2e-+H2O═CH3CHO+2H+ | |
| D. | b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 选用试刘 | |
| A | NaBr溶液(NaI) | 溴水 |
| B | CuCl2溶液(FeCl3) | 铜粉 |
| C | 乙烷(乙烯) | 氢气 |
| D | 溴苯(苯) | 液溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
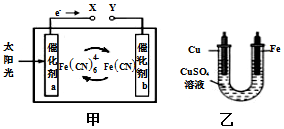 甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )
甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )| A. | 电池工作时,K+移向电极a | |
| B. | 电极b表面发生的电极反应Fe(CN)64--e-═Fe(CN)63- | |
| C. | Cu电极应与Y相连接,发生氧化反应 | |
| D. | 工作一段时间后,甲乙两装置中电解质溶液浓度均变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶于水呈酸性:NaHSO3═Na++H++SO32- | |
| B. | 在Na2S2O3溶液中滴加稀硫酸:2H++S2O32-═SO2↑+S↓+H2O | |
| C. | 浓盐酸与MnO2反应制氯气:MnO2+4HCl═Mn2++2Cl2+2H2O | |
| D. | 工业冶炼Mg:2Mg2++2O2-$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加压条件下有利于SO2和O2反应生成SO3 | |
| C. | 将NO2球浸泡在热水中颜色加深 | |
| D. | 加催化剂,使N2和H2在一定的条件下转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3COCH2CH3 | D. | 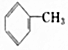 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com