
| A. | 漂白粉在溶液中存在平衡:ClO-+H2O?HClO+OH-,加少量NaOH能提高其漂白效率 | |
| B. | 硫酸钡难溶子水,但硫酸钡属于强电解质 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 物质的量浓度相同的四种溶液:①氯化铵②硫酸氢铵 ③次氯酸铵④碳酸铵的pH:④>②>①>③ |
分析 A.对于可逆反应ClO-+H2O?HClO+OH-,氢氧根浓度增大,平衡逆向移动;
B.强电解质指在水溶液中或熔融状态下完全电离的化合物;
C.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积;
D.硫酸氢铵完全电离出氢离子,溶液酸性最强,其pH最小;氯化铵溶液中铵根离子部分水解,溶液显示弱酸性;③次氯酸铵和④碳酸铵溶液中,次氯酸根离子、碳酸根离子的水解程度大于铵根离子,溶液显示碱性,且碳酸根离子的水解程度大于次氯酸根离子,则④的碱性更强,溶液的pH更大.
解答 解:A.加少量NaOH,氢氧根浓度增大,平衡ClO-+H2O?HClO+OH-逆向移动,则HClO的浓度减小,不能提高其漂白效率,故A错误;
B.强电解质指在水溶液中或熔融状态下能完全电离的化合物,硫酸钡属于强电解质,虽在水溶液中很难溶解,但溶于水的部分能完全电离,故B正确;
C.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故C错误;
D.物质的量浓度相同的四种溶液,①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中,②硫酸氢铵完全电离出氢离子,溶液酸性最强,溶液的pH最小;③次氯酸铵和④碳酸铵溶液中,次氯酸根离子、碳酸根离子的水解程度大于铵根离子,溶液显示碱性,且碳酸根离子的水解程度大于次氯酸根离子,则④的碱性更强,溶液的pH更大,所以溶液pH大小为:④>③>①>②,故D错误;
故选B.
点评 本题考查了化学平衡的移动原理、强弱电解质的判断、滴定实验的误差分析、盐的水解原理等知识,综合性较强,需要学生扎实的基础知识和灵活运用知识解决问题的能力,注意D选项越弱越水解,碱性越强.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
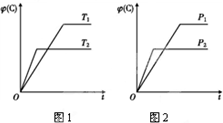 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡后,若使用催化剂,C的体积分数将增大 | |
| B. | 平衡后,若温度升高,化学平衡向正反应方向移动 | |
| C. | 平衡后,增加A的质量化学平衡向正反应方向移动 | |
| D. | 化学方程式中,化学计量数的关系为n<e+f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6g 硫粉与 11.2g 铁粉混合加热生成硫化亚铁 17.6g 时,放出 19.12KJ 热量.则Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸与 0.1mol?L-1NaOH 溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃烧生成液态水所放出的热量为 285.5KJ,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,则可知 C 的燃烧热△H=-110.5KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的还原性:X<Y<Z | B. | 单质的氧化性:X>Y>Z | ||
| C. | 酸性:H3ZO4>H2YO4>HXO4 | D. | 气态氢化物的稳定性:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com