
 ;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.分析 (1)根据磷原子核外电子排布写出最外层电子排布的轨道表示式;根据氧原子核外含有的能级数进行判断;
NaH2PO2中涉及到四种元素为Na、H、P和O,原子的电子层数越多,原子半径越大,若电子层相同,核电荷数越大,原子半径越小;
(2)根据磷元素所在的周期及离子电子层越少、核电荷数越大离子半径越小判断满足条件的元素名称,写出其最高价氧化物对应的水化物的电离方程式;
(3)磷酸二氢钠在溶液中存在水解和电离两个过程,溶液显示酸性,说明磷酸二氢根离子电离程度大于其水解程度.
解答 解:(1)磷元素原子核外最外层5个电子,磷原子的最外层电子轨道表示式 ;氧原子核外电子共有1s 2s 2p 3个能级,又s轨道有1种不同的伸展方向,p轨道有3种不同的伸展方向,所以氧原子共有4种不同的伸展方向,又氧原子最外层有6个电子,所以有6种不同运动状态的电子;NaH2PO2中含有的元素中,H原子电子层最少,原子半径最小,其次是氧原子的原子半径,钠原子和磷原子都含有三个电子层,磷原子的核电荷数大于钠原子,所以磷原子的原子半径小于钠原子,所以它们的原子半径关系为H<O<P<Na,
;氧原子核外电子共有1s 2s 2p 3个能级,又s轨道有1种不同的伸展方向,p轨道有3种不同的伸展方向,所以氧原子共有4种不同的伸展方向,又氧原子最外层有6个电子,所以有6种不同运动状态的电子;NaH2PO2中含有的元素中,H原子电子层最少,原子半径最小,其次是氧原子的原子半径,钠原子和磷原子都含有三个电子层,磷原子的核电荷数大于钠原子,所以磷原子的原子半径小于钠原子,所以它们的原子半径关系为H<O<P<Na,
故答案为: ;4;6; H<O<P<Na;
;4;6; H<O<P<Na;
(2)磷位于第三周期,第三周期中阳离子失去电子,电子层减少一层,离子半径最小,离子的核电荷数越大,离子半径越小,所以铝离子的半径最小;铝元素最高价氧化物对应的水化物为氢氧化铝,其电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)磷酸二氢钠的溶液中,磷酸二氢根离子电离程度大于水解程度,所以其水溶液显示酸性,故答案为:磷酸二氢根离子电离程度大于水解程度.
点评 本题考查了粒子比较大小比较、同主族元素性质递变规律与原子结构的关系,题目难度中等,试题涉及的内容较多,题量较大,充分考查了学生对学生知识的掌握情况.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 |  |  H2(g)+I2(g)?2HI(g) |  |  |
| 目的 | 检验碳与浓硫酸反应的氧化产物 | 验证压强对化学平衡的影响 | 检查碱式滴定管是否漏液 | FeSO4溶液的蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 石油是混合物,其分馏产品汽油也是混合物 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )| A. | 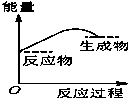 | B. | 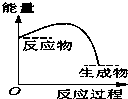 | C. | 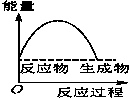 | D. | 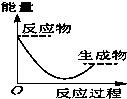 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com