
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| C2H4 | C2H6 | C2H6O | C3H6 | C3H8 | C3H8O | … |
| A. | C6H14 | B. | C7H14 | C. | C7H16 | D. | C7H16O |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | CH3COOH | C. | HNO2 | D. | HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
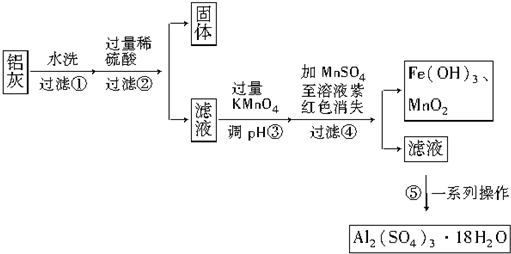
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 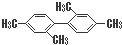 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 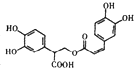 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x>a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x>b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x>c | 无明显变化 | 有Cl2 |
| Ⅴ | c<x<b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素阳离子的氧化性随着原子序数的递增依次增强 | |
| B. | 碱金属的密度随着原子序数的递增逐渐减小 | |
| C. | 随着原子序数的递增,碱金属元素最高价氧化物的水化物的碱性依次减弱 | |
| D. | 钾与氧气或水反应比钠的反应剧烈,铷、铯发生类似的反应更剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com