
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
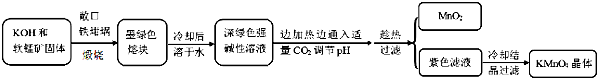
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
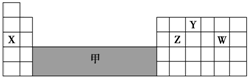
| A. | 可在灰色区域“甲”中寻找半导体材料 | |
| B. | X、Z、W 最高价氧化物对应的水化物之间两两能相互反应 | |
| C. | 气态氢化物的稳定性:Z<W | |
| D. | X只能形成一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 若反应X+Y=M是放热反应,该反应一定不用加热 | |
| D. | 硫酸与氢氧化钠发生中和反应生成水是放热反应,则水的能量比硫酸的能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
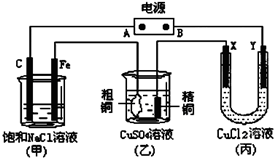 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素非金属性由强到弱的顺序是:X>Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 22.4L的二氧化硫气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 1 mol OH-离子中含有的质子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com