
| A. | 若混合物为Zn、Al,w不可能是0.1mol | |
| B. | 若混合物为Zn、Fe,w可能大于0.1mol | |
| C. | 若混合物为Fe、Mg,则加入的稀硫酸中溶质质量分数一定大于9.8% | |
| D. | 若混合物为Cu、Fe,w是0.05mol,则混合物中Fe与Cu的质量比1:1 |
分析 A.根据反应方程式利用极值法进行计算;
B.根据铁、锌与稀硫酸反应的方程式利用极值法分析;
C.镁和稀硫酸反应生成硫酸镁和氢气;
D.铜不与稀硫酸反应,根据反应方程式计算出铁的质量,然后计算出二者质量比.
解答 解:A.锌、铝和稀硫酸反应的化学方程式及其质的量关系为:Zn+H2SO4═ZnSO4+H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑,
65g 1mol 54g 3mol
由以上关系可知,5.6g锌和稀硫酸恰好完全反应生成的氢气小于0.1mol,5.6g铝和稀硫酸恰好完全反应生成的氢气大于0.1mol,因此若混合物为Zn、Al,w可能是0.1mol,故A错误;
B.铁和稀硫酸反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑,
56g 1mol,
5.6g铁和稀硫酸恰好完全反应生成的氢气的物质的量为0.1mol,由A中可知,5.6g锌和稀硫酸恰好完全反应生成的氢气小于0.1mol,因此若混合物为Fe、Zn,w一定小于0.1mol,w不可能大于0.1mol,故B错误;
C.设5.6g铁消耗硫酸的质量为y,5.6g镁消耗硫酸的质量为z,
Fe+H2SO4═FeSO4+H2↑,Mg+H2SO4═MgSO4+H2↑,
56 98 24 98
5.6g y 5.6g z
则:$\frac{56}{5.6}=\frac{98}{y}$,$\frac{24}{5.6}=\frac{98}{z}$,
y=9.8g,z=22.9g,
则加入的稀硫酸中溶质质量分数最小为:$\frac{9.8g}{100g}$×100%=9.8%,稀硫酸中溶质的最大质量分数为:$\frac{22.9g}{100g}$×100%=22.9%,所以该硫酸的质量分数一定大于9.8%,故C正确;
D.设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56g 1mol
x 0.05mol
则:$\frac{56}{x}=\frac{1}{0.05}$,
解得:x=2.8g,
则混合物中Fe和Cu的质量比为:2.8g:(5.6g-2.8g)=1:1,故D正确;
故选CD.
点评 本题考查混合物反应的计算,题目难度中等,试题侧重考查学生运用假设法和化学方程式进行计算和推断的能力,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
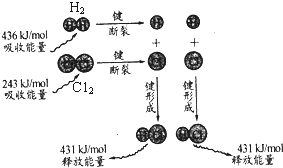
| A. | 2 mol 气态氢原子的能量低于1 mol 氢气 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 氢气与氯气反应的热化学方程式为H2(g)+C12(g)→2HCl(g)+183 kJ | |
| D. | 该反应在光照和点燃条件下的反应热效应是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
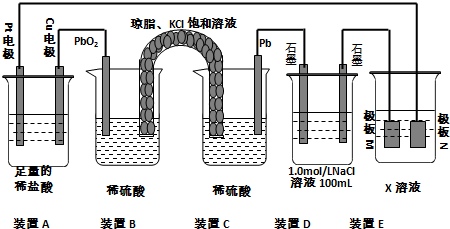
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2+2NaI=2NaBr+I2 | |
| B. | 2P+8H2O+5Br2=2H3PO4+10HBr↑ | |
| C. | 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ | |
| D. | SO2+2H2O+Br2=H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取氯气 | B. | 实验室制取氧气 | ||
| C. | 实验室制取二氧化碳 | D. | 实验室制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属在空气中燃烧都能生成M2O(M表示碱金属) | |
| C. | 随着原子序数的增加,碱金属的熔点降低 | |
| D. | 碱金属着火应用泡沫灭火剂更好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com