
(10分,每空2分)现有浓度均为0.1 mol/L的下列溶液:①醋酸、②硫酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦硫酸铵,⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由小到大的顺序是(填序号)__________________。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由小到大的顺序是(填序号)__________________ 。
(3)将③和④等体积混合后,混合液中各离子浓度由小到大的顺序是__________________。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)__________________25℃。在t℃时将pH=2的H2SO4的溶液a L与pH=11的NaOH溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(每空2分,总计10分)
(1)② ③ ① ④
(2)⑧ ⑤ ④ ⑥ ⑦
(3)c(H+)< c(NH4+) <c(OH-) <c(Cl-) =c(Na+)
(4) > 9 : 11。
解析试题分析:(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵等溶液中存在:NH4++H2O NH3?H2O+H+,其中硫酸铵溶液中铵根离子浓度最大,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,四种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这五种溶液中NH4+浓度最小,所以有:⑥⑦④⑤⑧,故答案为:⑥⑦④⑤⑧;
NH3?H2O+H+,其中硫酸铵溶液中铵根离子浓度最大,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,四种物质中NH4+浓度最小,⑧氨水为弱电解质,难以电离,在这五种溶液中NH4+浓度最小,所以有:⑥⑦④⑤⑧,故答案为:⑥⑦④⑤⑧;
(3)③和④等体积混合后,溶液溶质为NaCl和NH4Cl,由于溶液中存在:NH3?H2O NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+),故有:c(Na+)=c(CI-)>c(OH-)>c(NH4+)>c(H+)。
NH4++OH-,则c(Na+)=c(CI-)>c(NH4+),c(OH-)>c(H+),又溶液中存在水的电离,则c(OH-)>c(NH4+),故有:c(Na+)=c(CI-)>c(OH-)>c(NH4+)>c(H+)。
故答案为:c(Na+)=c(CI-)>c(OH-)>c(NH4+)>c(H+);
(4)t℃,KW=1×10-13,25℃,KW=1×10-14,已知水的电离为吸热过程,升高温度促进电离,KW增大,所以t℃大于25℃。
t℃时将pH=11的NaOH溶液中c(OH-)=  mol/L="0.01" mol/L,
mol/L="0.01" mol/L,
在t℃时将pH=11的NaOH溶液aL与pH=2的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,
则有:(0.01moL/L×bL-0.01mol/L×aL)/[ (a+b)L] =0.001mol/L,则a:b=9:11,
故答案为:>;9:11。
考点:离子浓度大小的比较电解质在水溶液中的电离盐类水解的原理
点评:本题考查溶液离子浓度大小的比较以及盐类的水解和弱电解质的电离等问题,题目难度较大,易错点为(1)(2),注意把握影响盐类水解以及电解质的电离的因素。


科目:高中化学 来源:2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷 题型:单选题
(10分,每空2分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高一上学期期中考试化学试卷(解析版) 题型:实验题
(10分,每空2分)
漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题:

(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U型管可以用内盛装__________的洗气瓶代替
(3)在制取氯气前,必须进行的一项操作步骤是__________________
(4)按照实验目的进行之后,干燥有色布条是否褪色( )(填是或否)。
(5)该兴趣小组在实验中,发现量筒中并没有收集到液体,你认为他们失败的原因可能是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三8月月考化学试卷(解析版) 题型:填空题
(10分,每空2分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1 817 |
2 745 |
11 578 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
A通常显____价,A的电负性__ __B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
。
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填字母)。
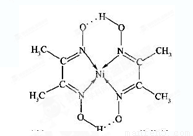
A.离子键 B.共价键
C.金属键 D.配位键 E.氢键
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高一上学期期中考试化学试卷 题型:填空题
(10分,每空2分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.摇匀后,液面下降,补充水
C.定容时仰视刻度线
D.在配制前用相同浓度的稀盐酸润洗容量瓶
(2)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L。
(3)在标准状况下,将_____________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得溶质质量分数为36.5%的盐酸。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷 题型:选择题
(10分,每空2分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。

(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com