
(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为 ;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32- (填“大”或“小”)外,还有
科目:高中化学 来源: 题型:阅读理解
(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出![]() 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也![]() 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的![]() 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质![]() 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(带解析) 题型:填空题
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):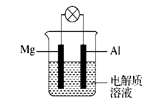
(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。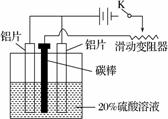
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
查看答案和解析>>
科目:高中化学 来源:炎德?英才大联考三湘名校2010届高三月考试卷(一) 题型:实验题
(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
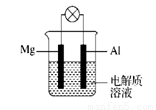
(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。
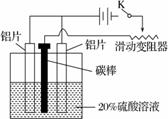
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
B.(12分) 实验化学
某化学研究小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
【实验目的】测定食醋的总酸量
【实验原理】中和滴定
【实验用品】蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),
0.1000mol/LNaOH标准溶液;100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
【实验步骤】
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定 往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
【数据记录】
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
【问题与思考】
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com