
| A. | 同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 | |
| B. | 当日光从窗隙射入灰尘飞扬的房间时,可观察到一束光线 | |
| C. | 明矾具有净水作用 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
分析 A.墨水是胶体,不同品牌墨水是不同的胶体;
B.胶体能发生丁达尔效应;
C.明矾净水是利用铝离子水解生成的氢氧化铝胶体具有吸附作用;
D.氯化铁溶液与氢氧化钠溶液发生复分解反应,产生红褐色沉淀.
解答 解:A.墨水是胶体,不同的墨水可能是不同的胶体,有的胶体胶粒(胶体本身不带电,胶粒带电荷)带正电、有的胶体胶粒带负电,带不同电荷的胶粒的胶体容易聚沉形成沉淀,所以,能把钢笔堵住是胶体的性质,故A错误;
B.当日光从窗隙射入暗室时,可观察到一束光线,这是丁达尔现象,是胶体的性质,故B错误;
C.明矾溶解后电离出的铝离子水解生成氢氧化铝胶体,具有较大面积有吸附性,可以净水,故C错误;
D.氯化铁溶液与氢氧化钠溶液发生复分解反应FeCl3+3NaOH=Fe(OH)3↓+3NaCl,产生红褐色沉淀,与胶体性质无关,故D正确;
故选D.
点评 本题考查胶体的性质,注意掌握胶体的性质是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 食品中加入维生素或钙、硒等是为了补充食品中缺乏的营养成分 | |
| B. | 抗生素能消炎抗菌,经常大量食用对人体有益无害 | |
| C. | 使用青霉素可能产生过敏反应,用药前一定要进行皮肤敏感试验 | |
| D. | 服用麻黄碱后可明显增加运动员的兴奋程度,但对其身体有极大的副作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图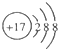 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①用砂纸摩擦后的镁带与沸水反应,再向反应 应后溶液中滴加酚酞 | A、浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 |
| ②钠与滴有酚酞试液的冷水反应 | B、产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③镁条与2mol•L-1的盐酸反应 | C、反应不十分强烈,产生无色气体 |
| ④铝条与2mol•L-1的盐酸反应 | D、剧烈反应,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E、生成白色胶状沉淀,继而沉淀消失 |
| 实验方案 | 实验现象(填写序号) |
| ① | B |
| ② | A |
| ③ | D |
| ④ | C |
| ⑤ | E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com