
| A�� | �٢ڢۢ� | B�� | �٢ڢܢ� | C�� | �٢ڢۢܢ� | D�� | �٢ڢܢݢ� |
���� ����������Һ��Ӧʵ�ʣ�����ˮ��Ӧ�����������ƣ��������������η������ֽⷴӦ��
���������������ͻ���������Ϊ���������кܸߵ��۵㣻
��̼�����Ʋ��ȶ������ȷֽ�����̼���ƺͶ�����̼��ˮ��
�ܹ���������ˮ��������̼��Ӧ�����������������������������������������ʷ�Ӧ����������������������������
�����������������ԣ���������������������
��̼���Ƽ���̫ǿ��������������θ������ҩ�
��� �⣺���ƵĻ�ԭ�Ժ�ǿ��������ͭ��Һ��Ӧ����������ͭ�����������ơ��������ò���ͭ���ʴ���
���������������ͻ���������Ϊ���������кܸߵ��۵㣬�ʴ���
��̼�����Ʋ��ȶ������ȷֽ�����̼���ƺͶ�����̼��ˮ�����Կ�����Ϊ���ͷۣ�����ȷ��
�ܹ���������ˮ��������̼��Ӧ�����������������������������������������ʷ�Ӧ�����������������������������ʴ���
�����������������ԣ���������������������������ˮ�����ɵ������������о�ˮ���ã�����������������ˮ�����ʴ���
��̼���Ƽ���̫ǿ��������������θ������ҩ�����θ�������̼�����ƣ��ʴ���
��ѡ��D��
���� ������Ҫ�������ʵ����ʡ�����Լ���;�����ʾ�����;����ȷ������ʵ������ǽ���ؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
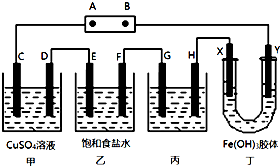 ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F��X��Y ���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ���Իش��������⣺
ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F��X��Y ���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ���Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ۢ� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
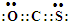 ��
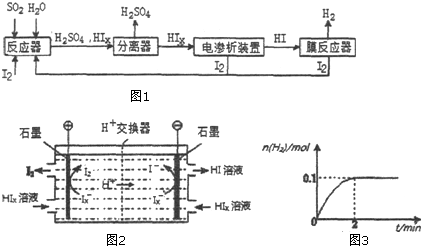
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com