
��ҵ�ϳ������÷�Ӧ���������������飬���ǰ��渱��Ӧ�ڡ�
��C2H4(g)+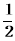 O2(g) ��
O2(g) ��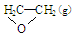 ; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
��1��д������������ȼ�յ��Ȼ�ѧ��Ӧ����ʽ����____________________________��
��2����ҵ�����У���ͨ��ijһ��ʩ���ӿ췴Ӧ�ٶ��Է�Ӧ��Ӱ���С���Ӷ���������������Ч�ʡ���ҵ������ȡ�����ִ�ʩ��_______________��
A�����߷�Ӧ��ϵ���¶�B��������ϵ��������Ũ��
C��ʹ�ú��ʵĴ���D�����ͷ�Ӧ��ϵ��ѹǿ
��3����֪C=C��O=O��C��C���ֱܷ�Ϊa kJ��mol-1��b kJ��mol-1��c kJ��mol-1������������C��O����Ϊ kJ��mol-1��
��4����Ӧ�ڿ�����Ƴ�ȼ�ϵ�أ����������������Һ��������Ӧʽ�� ��
��1��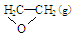 ��2.5 O2(g) = 2 CO2 (g) +2 H2O(g) ��H=��H2-��H1 ��2��C
��2.5 O2(g) = 2 CO2 (g) +2 H2O(g) ��H=��H2-��H1 ��2��C
��3��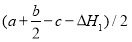 ��4��C2H4 - 12e- + 4 H2O = 2 CO2 +12 H+
��4��C2H4 - 12e- + 4 H2O = 2 CO2 +12 H+
��������
�����������1���ڣ��١������ɵû���������ȼ�յ��Ȼ�ѧ��Ӧ����ʽ��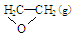 ��2.5 O2(g) = 2 CO2 (g) +2 H2O(g) ��H=��H2-��H1����2�������ٵ�����Ӧ�Ǹ����������С�ķ��ȷ�Ӧ�������Ǹ������������ķ��ȷ�Ӧ��A�����߷�Ӧ��ϵ���¶�, �١���������Ӧ���ʶ��ӿ졣���������⡣����B��������ϵ��������Ũ��,���ڷ�Ӧ���Ũ���������Է�Ӧ���ʶ��ӿ졣���������⡣����C������ֻ�ܶ�ijһ��Ӧ����Ӱ�죬����������Ӧû��Ӱ�졣����ʹ�ú��ʵĴ������ܼӿ췴Ӧ�ٶ��Է�Ӧ��Ӱ���С���Ӷ���������������Ч�ʡ��������⣬��ȷ��D�����ͷ�Ӧ��ϵ��ѹǿ������������Ӧ������Ũ�ȶ���С�����Է�Ӧ���ʶ�������������ȷѡ��ΪC����3����Ӧ�Ⱦ��Ƕϼ����յ��������γɼ��ͷŵ������IJ�ֵ����C=C��O=O��C��C���ֱܷ�Ϊa kJ��mol-1��b kJ��mol-1��c kJ��mol-1������٣������ɵû���������C��O����Ϊ
��2.5 O2(g) = 2 CO2 (g) +2 H2O(g) ��H=��H2-��H1����2�������ٵ�����Ӧ�Ǹ����������С�ķ��ȷ�Ӧ�������Ǹ������������ķ��ȷ�Ӧ��A�����߷�Ӧ��ϵ���¶�, �١���������Ӧ���ʶ��ӿ졣���������⡣����B��������ϵ��������Ũ��,���ڷ�Ӧ���Ũ���������Է�Ӧ���ʶ��ӿ졣���������⡣����C������ֻ�ܶ�ijһ��Ӧ����Ӱ�죬����������Ӧû��Ӱ�졣����ʹ�ú��ʵĴ������ܼӿ췴Ӧ�ٶ��Է�Ӧ��Ӱ���С���Ӷ���������������Ч�ʡ��������⣬��ȷ��D�����ͷ�Ӧ��ϵ��ѹǿ������������Ӧ������Ũ�ȶ���С�����Է�Ӧ���ʶ�������������ȷѡ��ΪC����3����Ӧ�Ⱦ��Ƕϼ����յ��������γɼ��ͷŵ������IJ�ֵ����C=C��O=O��C��C���ֱܷ�Ϊa kJ��mol-1��b kJ��mol-1��c kJ��mol-1������٣������ɵû���������C��O����Ϊ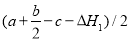 ����4�����ѷ�ӦC2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g)��Ƴ�ԭ��ء���ͨ��C2H4�ĵ缫Ϊ������ͨ��O2�ĵ缫Ϊ��������Ϊ���������������Һ�����Ը�����Ӧʽ��C2H4 - 12e- + 4 H2O = 2 CO2 +12 H+�������ĵ缫ʽ��O2 +4e-+ 4H+= 2H2O.
����4�����ѷ�ӦC2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g)��Ƴ�ԭ��ء���ͨ��C2H4�ĵ缫Ϊ������ͨ��O2�ĵ缫Ϊ��������Ϊ���������������Һ�����Ը�����Ӧʽ��C2H4 - 12e- + 4 H2O = 2 CO2 +12 H+�������ĵ缫ʽ��O2 +4e-+ 4H+= 2H2O.
���㣺�����Ȼ�ѧ����ʽ����д����������Ի�ѧ��Ӧ���ʵ�Ӱ�졢��Ӧ������ܵĹ�ϵ��ԭ��ص���ơ�


 Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ��һ��ѧ������һ����ѧ�Ծ��������棩 ���ͣ������
��һ��ɫ������Һ��Ҫȷ���Ƿ����������ӣ�H+��K����Mg2����Al3����Fe2����Ba2����NO3����SO42����Cl����I����HCO3����ȡ����Һʵ�����£�
ʵ�鲽�� | ʵ������ |
(1)ȡ��������Һ���Ӽ�����ɫʯ����Һ | ��Һ���ɫ |
(2)ȡ��������Һ����Ũ������CuƬ��ŨH2SO4������ | ����ɫ����������������������Ա�ɺ���ɫ |
(3)ȡ��������Һ����BaCl2��Һ | �а�ɫ�������� |
(4)ȡ(3)���ϲ���Һ����AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����HNO3 |
(5)ȡ��������Һ����NaOH��Һ | �а�ɫ�������ɣ���NaOH����ʱ���������ܽ� |
�ɴ��жϣ�
��1����Һ�п϶����ڵ������� ����Һ�п϶������ڵ������� ��
��2��Ϊ��һ��ȷ���������ӣ�Ӧ�ò����ʵ�鼰��Ӧ�������ӵ�����(��Ϊ��Һ��Ӧ��˵��ʹ���Լ������ƣ�����д��ϸ��������)�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ��һ��ѧ����ĩ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����۰˺š��ɴ��ɹ��������գ��������롰�칬һ�š�����Խ�֮�á�����������һ�������¾��ɲ��������������������Ա����������ṩ������������
A��KMnO4 B��Na2O2 C��KClO3 D��H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���л������������Ӱ뾶�������Ӱ뾶֮�������� ( )
A��LiI B��NaBr C��KCl D��CsF
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ�����и߶���һѧ�ڽ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���˽�����AG��ʾ��Һ��ȣ�AG����Ϊ AG=lg[c(H+)/c(OH-)]���ش��������⣺
��1��25��ʱ����Һ��AG����pH֮��Ĺ�ϵΪAG= ��
��2��25��ʱ��һԪ����MOH��Һ��AG=��8��ȡ20mL��MOH��Һ������16.2mL 0.05 mol/L������ʱ������ǡ����ȫ�к͡���������¸�һԪ����ĵ���ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ�����и߶���һѧ�ڽ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
������NH4I�����ܱ������У���һ���¶��·������з�Ӧ��
��NH4I(s)  NH3(g) + HI(g) ��2HI(g)
NH3(g) + HI(g) ��2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
�ﵽƽ��ʱ��c��H2��=0.5mol/L��c��NH3��=4mol/L������¶��·�Ӧ�ٵ�ƽ�ⳣ��Ϊ
A��9 B��12 C��16 D��20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ�����и߶���һѧ�ڽ�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�ܱ������У���Ӧ aA(g)  bB(g)+cC(g)��ƽ������¶Ȳ��䣬�������������һ�������ղ��A�����ʵ�����Ũ�ȱ�Ϊԭ����50%����
bB(g)+cC(g)��ƽ������¶Ȳ��䣬�������������һ�������ղ��A�����ʵ�����Ũ�ȱ�Ϊԭ����50%����
A��ƽ��������Ӧ�����ƶ� B��a��(b+c)
C������B�������������� D�������ж϶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ�ĵ���У�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���Ԫ�����ʵĵݱ����������ǣ� ��
A��Li��Be��Bԭ��������������������
B��C��P��SԪ�����������������
C��N��O��F�縺����������
D��Na��K��Rb��һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ʯ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����и���Һ��������һ���ܴ����������
A��ǿ������Һ����K����Al3����CH3COO����SO42��
B��ˮ���������c(H+)=10��13mol/L����Һ��K+��HCO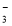 ��Br����Ba2+
��Br����Ba2+
C����������pH��1����ɫ��Һ����NH4����Mg2+��SO42����Cl-
D����������pH��1����Һ����Na����Fe2����NO3����SO42��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com