
| A、1 | B、2 | C、0 | D、18 |
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2010年江苏省海安县南莫中学高二下学期期末考试化学 题型:填空题
(15分)下表是元素周期表的一部分。
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
| A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物 |
| B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨ |
| C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物 |
| D.元素⑩的电负性大于元素⑨ |
 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱)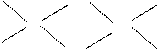 Cl Cl Cl
Cl Cl Cl查看答案和解析>>
科目:高中化学 来源:2014届云南省高二上学期期中考试化学试卷(解析版) 题型:选择题
某元素负一价阴离子的核外有10个电子,该元素在周期表中的位置是
A.二周期IA族 B.三周期ⅦA族 C.二周期ⅦA族 D.三周期IA族
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二下学期期末考试化学 题型:实验题
(15分)下表是元素周期表的一部分。
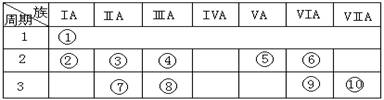
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物
B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨
C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物
D.元素⑩的电负性大于元素⑨
⑵某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,与该元素单质分子互为等电子体的二价阴离子是 。
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式:
。
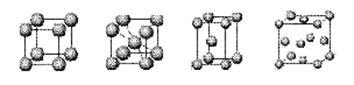
⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。
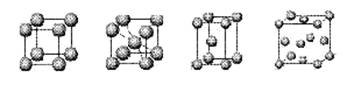
甲 乙 丙 丁
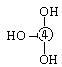
⑸元素④的含氧酸的结构式可表示为 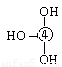 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱)
一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 。
⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键
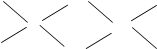 Cl
Cl Cl
Cl
Cl Cl
Al Al
Cl Cl Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com