
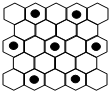
石墨是正六边形的平面层状结构,石墨同层内每个正六边形平均占有________个碳原子,平均占有________个碳一碳键。
晶体硅是正四面体的空间网状结构,晶体硅中每个硅原子与________个硅原子的共价键相结合,形成一个________的形状。晶体硅中硅原子个数与硅一硅键数之比为________。
在石墨晶体同一层中,每一个碳原子与其他相邻的3个碳原子形成碳一碳键,构成正六边形。就一个碳原子来说,它可以与其他碳原子形成3个正六边形,对每个正六边形而言,这个碳原子实际只提供了 金刚石和晶体硅都是一种空间网状的原子晶体结构,每个硅原子分别与4个硅原子以共价键相结合,它们分别在正四面体的中心和四个顶点。晶体中所有硅一硅键长、键角、键能都相等。晶体中每个硅原子参与四个硅一硅键的形成,每个硅原子对一个键只提供
|


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
晶体硅是正四面体的空间网状结构,晶体硅中每个硅原子与________个硅原子的共价键相结合,形成一个________的形状。晶体硅中硅原子个数与硅一硅键数之比为________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
晶体硅是正四面体的空间网状结构,晶体硅中每个硅原子与________个硅原子的共价键相结合,形成一个________的形状。晶体硅中硅原子个数与硅一硅键数之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com