
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: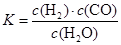
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。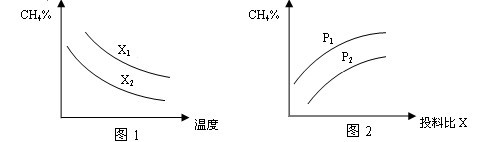
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
(14分毎空2分)
Ⅰ、(1) C(S)+H2O(g) H2(g) + CO(g) (可不标状态,不写可逆号0分)
H2(g) + CO(g) (可不标状态,不写可逆号0分)
(2) ①< ;②<
(3)①c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+);②C6H12O6-24e-+6H2O=6CO2+24H+
Ⅱ、(1)10︰1 (2)2×10-9/(c-0.02)
解析试题分析:Ⅰ、(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的化学方程式是C(S)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
(2)①根据反应的化学方程式CH4+H2O CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。
CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。
②根据方程式可知,该反应是体积增大的,所以在投料比相同的条件下,压强越大,甲烷的转化率越小,则甲烷的含量越高,所以根据图 2可知,P2<P1。
(3)①在该燃料电池中,甲烷在负极通入,氧气在正极通入。参加反应的氧气是0.2mol,得到0.8mol电子,所以消耗甲烷的物质的量是0.8mol÷8=0.1mol,生成CO2是0.1mol,但溶液中氢氧化钾是0.15mol,所以反应中生成碳酸钾和碳酸氢钾,且二者的物质的量均是0.05mol。由于CO32-的水解程度大于HCO3-的水解程度,所以放电后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+)。
②原电池中负极失去电子,所以葡萄糖在负极放电,电极反应式是C6H12O6-24e-+6H2O=6CO2+24H+。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,所以该温度下水的离子积常数=1×10-13,所以pH=12的NaOH溶液中OH-的浓度是0.1mol/L。所得混合液为中性,这说明二者恰好反应,则VaL×0.01mol/L=VbL×0.1mol/L,解得Va︰Vb=10︰1。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,因此根据电荷守恒可知,溶液中c(CH3COO-)=c(Na+)=0.01mol/L,则溶液中c(CH3COOH)=(0.5c-0.01)mol/L。又因为溶液中c(H+)=1×10-7mol/L,所以根据醋酸的电离常数表达式可知Ka=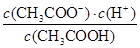 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
考点:考查平衡常数、外界条件对平衡状态的影响;原电池原理的音乐;溶液中离子浓度大小比较;以及溶液pH和电离常数的有关计算等


科目:高中化学 来源: 题型:问答题
在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b%。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol N2,反应达平衡时有3a mol NH3生成,N2的转化率仍为b%。则x= ;
y= 。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达平衡时N2转化率仍为b%,则x、y的关系为 ;z的取值范围为 。
(3)在恒温[与(1)温度相同]和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时N2的转化率为c%,则b、c的关系为 (用“<”、“=”或“>”表示),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(11分)在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率; (2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
|

 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
①恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是________(填序号);
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);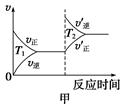
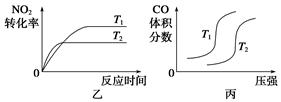
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
| 4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
| 实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实(常温下)不能说明醋酸是弱电解质的是
| A.醋酸钠溶液pH>7 |
| B.醋酸溶液能溶解碳酸钙 |
| C.0.1mol·L-1醋酸溶液pH=2.9 |
| D.pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com