
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下 ,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)
,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=______________________。
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为_______________________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①_______________________;②_______________________。
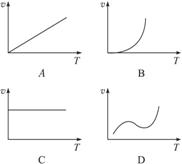
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是_______________________。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:____________________________________。欲使上述体系中Al3+浓度增加,可加入的物质是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3↓+Na2SO4 FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是
。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
。
 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是
。
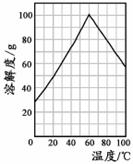
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则镉晶胞的体积是
cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,己知Ar(Cu)=63.6);
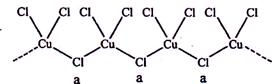
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
|
| 实验Ⅰ | 2mL银氨溶液和数 滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ | 2mL银氮溶液和 数滴浓氨水 | 有气泡产生: 一段时间后,溶液 无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.
b.AgOH不稳定,极易分解为黑色Ag2O
(I)配制银氨溶液所需的药品是 。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是 。
②产生Ag2O的原因是 。
(3)该同学对产生银镜的原因提出瑕设:可能是NaOH还原Ag2O。实验及现象:向AgNO3
 溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在NaOH存在下.可能是NH3,
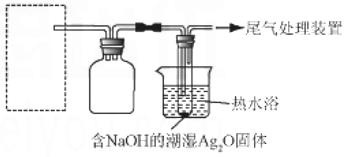
还原Ag2O。用右图所示装置进行实验.现象:
出现银镜。在虚线框内画出用生石灰和浓
氨水制取NH3的装置简图(夹持仪器 略)。
略)。
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3,还原Ag2O的反应.进行如下实验:
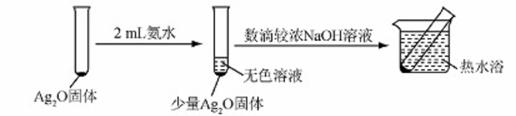
有部分Ag2O溶解在氨水中,该反应的化学方程式是 。
验结果证实假设成立,依据的现象是 。
用HNO3,消洗试管壁上的Ag,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.离子晶体 C.原子晶体 D.金属晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com