
①在1.520 g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15 min。离子方程式为:![]() +I2+2
+I2+2![]() ====
====![]() +2I-+2CO2↑+H2O
+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250 mL溶液。
③在②所得溶液中取25 mL,滴加甲酸,除去其中过量的Br2。
方程式为:Br2+HCOOH====2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 mol·L-1 Na2S2O3 15.10 mL。离子方程式为:I2+2![]() ====2I-+
====2I-+![]()
回答下列问题:
(1)写出②④两步操作中所发生反应的离子方程式。
(2)①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量分数。
(1)②I-+3Br2+3H2O====![]() +6Br-+6H+;
+6Br-+6H+;
④6H++![]() +5I-====3I2+3H2O;
+5I-====3I2+3H2O;
(2)防止未反应的I2进入水溶液中。
(3)关系式:![]() —2I-—2
—2I-—2![]() —6I2—12
—6I2—12![]()
n(Na2SO3)=0.112 0 mol·L-1×0.015 10 L÷12÷25 mL×250 mL=1.409×10-3 mol
m(Na2SO3)=0.177 5 g
w(Na2SO3)=11.68%
解析:该题属定量分析实验的考查,内容新颖。
首先明确该定量分析的反应式为:
I-+3Br2+3H2O====![]() +6Br-+6H+
+6Br-+6H+
![]() +I2+2
+I2+2![]() ====
====![]() +2I-+2CO2↑+H2O
+2I-+2CO2↑+H2O
6H++![]() +5I-====3I2+3H2O
+5I-====3I2+3H2O
I2+2![]() ====2I-+
====2I-+![]()
总关系式为:![]() —2I-—2
—2I-—2![]() —6I2—12
—6I2—12![]()
n(![]() )=0.1120 mol·L-1×0.01510 L÷12÷25 mL×250 mL=1.409×10-3 mol
)=0.1120 mol·L-1×0.01510 L÷12÷25 mL×250 mL=1.409×10-3 mol
m(Na2SO3)=1.409×10-3 mol×126 g·mol-1=0.1775 g
w(Na2SO3)=![]() ×100%=11.68%
×100%=11.68%


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
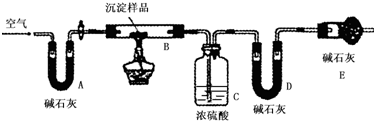
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) | |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
查看答案和解析>>
科目:高中化学 来源:2007年1月江苏省如皋中学高三化学期末综合练习-新人教 题型:038
实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520 g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15 min.离子方程式为:
SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O.
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250 mL溶液.
③在②所得溶液中取25 mL,滴加甲酸,除去其中过量的Br2.
方程式为:Br2+HCOOH=2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液.
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 mol/L Na2S2O3 15.10 mL.离子方程式为:I2+2S2O32-=2I-+S4O62-.回答下列问题:
(1)写出②、④两步操作中所发生反应的离子方程式.
(2)①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量百分含量.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为:SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。离子方程式为:6H++IO3-+5I-=3I2+3H2O
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120mol/L Na2S2O3 15.10mL。离子方程式为:I2+252O32-=2I-+S4O62-
回答下列问题:
(1)写出②、③三步操作中所发生反应的离子方程式。
(2)①中为什么要用0.13% I2的氯访溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量百分含量。
查看答案和解析>>
科目:高中化学 来源: 题型:
①在1.520 g样品中加入碳酸氢钾溶液、0.13%I2的氯仿溶液,在分液漏斗中振荡15 min。离子方程式为:
![]() +I2+2
+I2+2![]() ====
====![]() +2I-+2CO2↑+H2O
+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250 mL溶液。
③在②所得溶液中取25 mL,滴加甲酸,除去其中过量的Br2。方程式为:Br2+HCOOH====2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.112 0 mol·L-1 Na2S2O315.10 mL。
离子方程式为:I2+2![]() ====2I-+
====2I-+![]()
完成下列问题:
(1)写出②④两步操作中所发生反应的离子方程式。
(2)①中为什么要用0.13%I2的氯仿溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量百分含量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com