

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.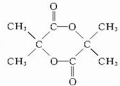 .
. 分析 F含有碳碳双键,发生加聚反应生成高分子化合物PMAA,故PMAA为 ,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为
,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为 ,逆推可知D为
,逆推可知D为 ,C为
,C为 ,B为
,B为 ,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3,据此解答.
,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3,据此解答.
解答 解:F含有碳碳双键,发生加聚反应生成高分子化合物PMAA,故PMAA为 ,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为
,A与氯气反应得到B,B发生卤代烃的水解反应生成C,C连续发生氧化反应生成E,E在浓硫酸、加热条件下生成F,应是发生消去反应,故E中含有-OH、-COOH,且-OH连接的碳原子上没有氢原子,故E为 ,逆推可知D为
,逆推可知D为 ,C为
,C为 ,B为
,B为 ,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
,反应①为烯烃的加成反应,故A为CH2=C(CH3)-CH3.
(1)由上述分析可知,A的结构简式为:CH2=C(CH3)-CH3,PMAA的结构简式为 ,
,
故答案为:CH2=C(CH3)-CH3; ;
;
(2)反应①是烯烃发生加成反应,反应②是卤代烃的水解反应,属于取代反应,反应③是醇发生消去反应生成碳碳双键,
故答案为:加成反应;取代反应;消去反应;
(3)反应③的化学方程式: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O,
故答案为: $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O;
(4)E( )在浓硫酸存在并加热的条件下,还能生成一种环状产物,应发生酯化反应生成环酯,该环状化合物的结构简式是
)在浓硫酸存在并加热的条件下,还能生成一种环状产物,应发生酯化反应生成环酯,该环状化合物的结构简式是 ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意根据F的结构与反应条件抓住碳链骨架进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 HSO3-+OH-
HSO3-+OH-| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g/mol | |
| B. | 2g H2含有的氢原子数为6.02×1023 | |
| C. | 标准状况下,1mol SO3的体积为22.4L | |
| D. | 1L 1mol•L-1 NaOH溶液中含1mol Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2的电子式为: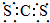 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com