


科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | NO2 | SiO2 |
| 熔点℃ | 920 | 801 | 1291 | 190 | -107 | 2073 | -93 | 1723 |
| c(N2O4) |
| c2(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.117 |
| B、0.351g |
| C、0.585g |
| D、0.234g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g苯中含有碳碳双键3NA个 |
| B、1mol甲基(-CH3)含有电子数为10NA个 |
| C、14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、在标准状况下,11.2L辛烷中的碳原子数为4 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
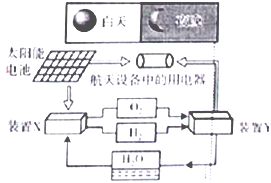 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次氯酸的结构式:H-Cl-O |
| B、CCl4、CS2、NCl3中所有原子都满足最外层为8个电子的稳定结构 |
C、对硝基苯酚的结构简式为 |
D、聚丙烯的结构简式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 100℃ | 300℃ | 500℃ |
| K | 0.125 | 0.95 | 3.2 |
| c(CO2)?[c(N2)]2 |
| c(N2O)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B、无色透明的溶液中:Ba2+、H+、MnO4-、Br- |
| C、使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- |
| D、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- | ||
C、
| ||
| D、c(I-)=0.1 mol?L-1的溶液中:Na+、H+、ClO-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com