
【题目】乙烯可用于合成纤维、橡胶、塑料等。回答下列问题:
(1)用CPO3作催化剂,CO2重整C2H6制乙烯的反应如下:
C2H6(g)=C2H4(g)+H2(g) △H1
H2(g)+CO2(g)=H2O(g)+CO(g) △H2
反应C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
(2)向一体积为2 L的恒容密闭容器中充入0.1 mol C2H6和0.1 mol CO2发生反应: C2H6(g ) +CO2 (g )=C2H4 (g) +CO(g) + H2O(g ),C2 H6的平衡转化率与温度的关系如图所示。

①该反应的正反应为________(填“放热”或“吸热”)反应。
②在相应温度下,A点反应速率(正 )_________(填“>”“<"或“=”)![]() 。
。
③B点在相应温度下的平衡常数K= ______ 。
④容器中反应达到平衡后,若要增大C2H6的转化率,除升高温度外,还可采取的措施有__________(任答一条)。
【答案】 △H1+△H2 吸热 > 0.025(或0.025mol·L-1) 向容器中再充入一定量的CO2(或将H2O(g)从体系中分离出来)
【解析】(1)已知:①C2H6(g)=C2H4(g)+H2(g) △H1 ;②H2(g)+CO2(g)=H2O(g)+CO(g) △H2 ;根据盖斯定律可知由①+②可得反应C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) ,则△H=△H1+△H2;
(2)①平衡转化率随温度升高而增大,说明升高温度平衡正向进行,则该反应的正反应为吸热反应;
②在相应温度下,A点反应物转化率较平衡点B低,说明此时反应正向进行,即反应速率(正 )>![]() ;
;
③B点时C2H6的平衡转化率为50%,则
C2H6(g ) +CO2 (g )=C2H4 (g) +CO(g) + H2O(g )
起始浓度(mol/L) 0.05 0.05 0 0 0
变化浓度(mol/L) 0.025 0.025 0.025 0.025 0.025
平衡浓度(mol/L) 0.025 0.025 0.025 0.025 0.025
B点在相应温度下的平衡常数K=![]() =0.025;
=0.025;
④容器中反应达到平衡后,若要增大C2H6的转化率,除升高温度外,还可向容器中再充入一定量的CO2(或将H2O(g)从体系中分离出来)。


科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
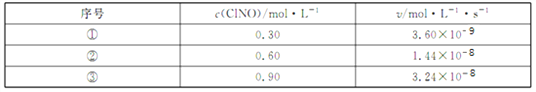
n =____________;k =__________________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )

A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 在沸水中滴入含0.1mol FeC13的FeC13饱和溶液,制得Fe(OH)3胶粒数为0.1 NA
B. lmol O2参加反应转移电子数一定为4NA
C. lmol铁和标准状况下22.4L C12充分反应,转移的电子数为3NA
D. 常温常压下,32g O2含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)适量的N2和O2完全反应,每生成23 g NO2吸收16.95 kJ 热量。N2与O2反应的热化学方程式为____________________________。
(2)已知拆开1 mol H—H、1 mol N—H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(3)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为___________________。
(4)在一定条件下,将1 mol N2和3 mol H2充入一密闭容器中发生反应生成氨气,达到平衡时N2的转化率为25%,放出Q kJ的热量,写出N2与H2反应的热化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在水电离出的c(H+)=10-14mol/L的溶液中,一定能大量共存的( )
A.K+、Na+、HCO3-、Cl-B.K+、Br-、AlO2-、Cl-
C.SO42-、Na+、NO3-、Cl-D.SO42-、NH4+、Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能是指在298 K、1.01×105 Pa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。已知键能:H—H为436 kJ mol1;Cl—Cl为243 kJ mol1; H—Cl为431 kJ mol1。下列说法中不正确的是
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=183 kJ mol1
2HCl(g) ΔH=183 kJ mol1
D.此反应的热化学方程式为:![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g) ΔH=91.5 kJ mol1
HCl(g) ΔH=91.5 kJ mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com