
在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
①Cl2 ②SiH4 ③SO2 ④邻二甲苯 ⑤乙烷 ⑥丁烷
【解析】①②⑤三组气体中的分子均为组成结构相似的分子,只要从相对分子质量的大小就可以判断更易液化的气体分别是各组气体中相对分子质量较大的分子,即①Cl2、②SiH4、⑤乙烷。③组中SO2的相对分子质量大于CO2的相对分子质量,并且SO2是极性分子,所以SO2分子间的范德华力大于CO2分子间的范德华力,故SO2易液化。④组中的邻二甲苯、对二甲苯的相对分子质量相等,邻二甲苯是极性分子,对二甲苯是非极性分子,所以邻二甲苯分子间的范德华力大于对二甲苯分子间的范德华力,故邻二甲苯易液化。⑥组中丁烷、异丁烷是同分异构体,异丁烷分子含有支链,使分子间接触面积减小,分子间作用力减小,所以丁烷分子更易液化。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2014年高考化学 题型二 化学用语型专题练习卷(解析版) 题型:选择题
下列化学用语表达正确的是( )
A.对硝基甲苯的结构简式: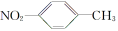
B.CH2F2的电子式: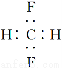
C.16O2与18O2互为同素异形体
D.乙炔的最简式:CH
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型一 化学社会型专题练习卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.用CO2合成聚碳酸酯可降解塑料,可实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学训练1.2.2核外电子排布元素周期表练习卷(解析版) 题型:选择题
关于同一种元素的原子或离子,下列叙述正确的是( )。
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子比带正电荷少的阳离子半径大
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:填空题
已知N、P同属元素周期表的第ⅤA族元素,N在第二周期,P在第三周期,NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N—H键间的夹角是107.3°。
(1)PH3分子与NH3分子的构型关系是____________(填“相同”、“相似”或“不相似”)______________(填“有”或“无”)P—H键,PH3分子是______________(填“极性”或“非极性”)分子。
(2)NH3与PH3相比,热稳定性更强的是____________,原因是_____________。
(3)NH3和PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________________。
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:选择题
下列各组物质汽化或熔化时,所克服的微粒间作用力属于同种类型的是( )。
①碘和干冰的升华
②二氧化硅和生石灰熔化
③氯化钠和铁的熔化
④苯和己烷的蒸发
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+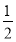 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+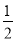 。则A、B两元素所形成化合物的晶体类型为( )。
。则A、B两元素所形成化合物的晶体类型为( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:选择题
用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( )。
A.云母是热的不良导体,传热不均匀
B.石蜡是热的不良导体,传热不均匀
C.石蜡具有各向异性,不同方向导热性能不同
D.云母具有各向异性,不同方向导热性能不同
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:填空题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
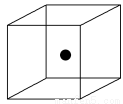
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com