
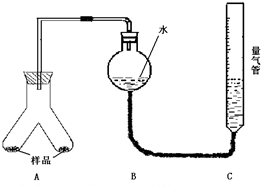
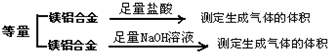
 为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:| 足量NaOH溶液 |
| 0.1mol |
| 1.25mol/L |
| 336 |
| Vm |
| 22.4 |
| Vm |
| 11.2 |
| Vm |
| 44.8 |
| 3Vm |
| ||||
|


科目:高中化学 来源: 题型:
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子 |
| C、12g NaHSO4在熔融时离子总数为0.3NA个 |
| D、标准状况下,11.2L氦气所含的原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
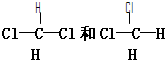 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和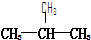
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R元素属于ⅡA族 |
| B、R元素在周期表里处于第4周期 |
| C、R元素最高氧化物对应水化物的分子式为H2R04 |
| D、R元素气态氢化物的分子式为H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:
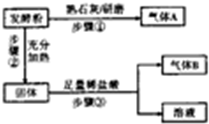 发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:
发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:| 实验步骤 | 预期现象 |
| 1.取适量样品溶于稀盐酸后,将溶液分成两份 | |
| 2. | |
| 3. | |
查看答案和解析>>
科目:高中化学 来源: 题型:
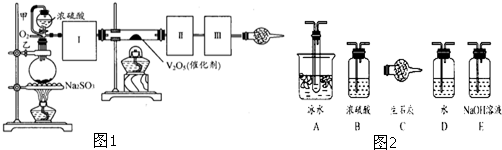
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3 +5 | +2 +4 | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
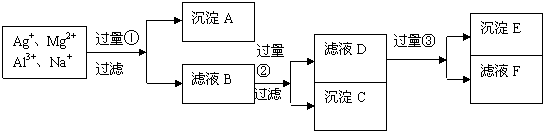
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com