
����Ŀ����ѧ��Ӧ�е������仯�������ȡ��������Ҫ;����
��1��Һ������һ����Ҫ�ļ���ȼ�ϣ�����ʾ��ͼ��Һ������ȼ�չ����е������仯���������������ĸ���� 
��2���������������ڶ�ʱ�䱣��ʳ���һ������̼���ƾ���������茶����ܷ���һ���ϴ��У���������ס���ϴ��м䲿�֣�ʹ���־�����������ɡ���������ʹ��ʱ���������£����ֽ��������ֹ����ĩ��ֻ�ϣ��������������£��ɴ��жϣ���Ӧ�����ɲ����������������ڡ����ڡ���̼���ƾ���������茶������������
��3����ѧ��Ӧ�е������仯����������Ϊ�����ı仯����ʱ�����Ա���Ϊ������ʽ�������仯�����磬����ȼ�տ�������������������ǽ���ѧ��ת��Ϊ���ܺ��������ձ�ʹ�õĸɵ�ع���ʱ�ǽ���ѧ��ת��Ϊ ��
���𰸡�
��1��A
��2������
��3�����ܣ�����
���������⣺��1��Һ����ȼ�չ����Ƿ��ȷ�Ӧ�����������������������ȼ����Ҫ�õ��������������ܷ�Ӧ��������Ҫ�е������� A��ͼ��Ӧ���������������ﷴӦ�Ƿ��ȷ�Ӧ����Ӧ��Ҫ�õ�����������������ͼ�����Һ����ȼ�յ������仯��ϵ����A��ȷ��
B��ͼ���з�Ӧ�������������������������ʾ�������ȹ��̣�������Һ����ȼ�շ��ȣ���B����
C��ͼ���з�Ӧ�����������������������������Һ����ȼ�շ��ȣ���C����
���Դ��ǣ�A����2����һ������̼���ƾ���������茶����ܷ���һ���ϴ��У�ʹ�������ֹ����ĩ��ֻ�ϣ��������������£�˵���¶Ƚ���������С���������ݷ�Ӧǰ�������غ㣬��Ӧ�����ɲ��������������̼���ƾ���������茶������������
���Դ��ǣ����ڣ���3�����ʱ仯�����е������������仯������֪����ѧ�ܿ���ת�����ܡ����ܡ����ܵ���ʽ�������������������������ǽ���ѧ��ת��Ϊ���ܣ�ͬʱ�ͷ���������ѧ��ת��Ϊ���ܣ������ձ�ʹ�õĸɵ�أ����õ���ԭ���ԭ�����ǽ���ѧ��ת��Ϊ���ܣ�
���Դ��ǣ����ܣ����ܣ�
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�����֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ�����ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mlŨH2SO4��Һ���������м���3.2g Cu���ڼ��������³�ַ�Ӧ��
��1����Ӧ���ĵ�H2SO4�����ʵ����� �� ����SO2�����Ϊ����״���£�mL��
��2���������Ũ��������ʵ���Ũ��Ϊa molL��1 �� Ͷ��������ͭƬ���ȣ���ַ�Ӧ����ԭ����������ʵ���n��H2SO4��0.025a mol������ڡ��������ڡ���С�ڡ�����
��3��������з�Ӧ�����Һϡ�͵�500mL��ȡ��50mL������ȡ��Һ�м���������BaCl2��Һ���õ�����19.81g����ԭŨ��������ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������£�±�����봼��Ӧ�����ѣ�![]() ����
����
![]()
������![]() �������IJ���Ӧ�ɵó����ܼ�����ૣ���Ӧ��ͼ���£�
�������IJ���Ӧ�ɵó����ܼ�����ૣ���Ӧ��ͼ���£�

![]() ��
��![]() ��Ϊͬ���칹�壬��ش��������⣺
��Ϊͬ���칹�壬��ش��������⣺
��1��![]() ��
��![]()
![]() ��һ��������ǡ�÷�Ӧ�����ɱ���һԪ��
��һ��������ǡ�÷�Ӧ�����ɱ���һԪ��![]() ��
�� ![]() �ķ���ʽΪ
�ķ���ʽΪ![]() ��
�� ![]() �Ľṹ��ʽΪ_________________��
�Ľṹ��ʽΪ_________________��
��2���ڢ٢۲���Ӧ���ͷֱ�Ϊ_______________��Ӧ����_______________��Ӧ��
��3��������![]() ���еĻ�ѧ���ʣ���д��ĸ���ţ���_______________��
���еĻ�ѧ���ʣ���д��ĸ���ţ���_______________��
![]() ���ɷ�����������Ӧ
���ɷ�����������Ӧ
![]() ����Ũ���Ṳ�Ȼ����������ƵĴ���Һ���Ⱦ��ܷ�����ȥ��Ӧ
����Ũ���Ṳ�Ȼ����������ƵĴ���Һ���Ⱦ��ܷ�����ȥ��Ӧ
![]() ���ɷ���������Ӧ
���ɷ���������Ӧ
![]() ���������¿ɷ����Ӿ۷�Ӧ
���������¿ɷ����Ӿ۷�Ӧ
��4���˴Ź���������ʾ![]() �������������⣬д��
�������������⣬д��![]() �Ļ�ѧ��Ӧ����ʽ��_______________��
�Ļ�ѧ��Ӧ����ʽ��_______________��
��5������ૣ�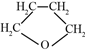 ���ж���ͬ���칹�壬д���������������Ľṹ��ʽ____________��
���ж���ͬ���칹�壬д���������������Ľṹ��ʽ____________��
����״ �ں����Ѽ� �ۺ˴Ź���������ʾ���������͵���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʷ������ȷ�����(����)
���� | A | B | C | D |
�� | ���� | �ռ� | ������ | ���Լ� |
�� | ���� | ���� | ���� | ���� |
�� | �ռ� | ʳ�� | өʯ | �մ� |
���������� | ������ | ����þ | �������� | ������ |
���������� | ������̼ | һ����̼ | �������� | �������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����з�Ӧ��ˮ���������淴Ӧʱ��ı仯���Ʒ�����ͼ����(����)

A. CO2(g)��H2(g) ![]() CO(g)��H2O(g)����H��0
CO(g)��H2O(g)����H��0
B. CH3CH2OH(g )![]() CH2===CH2(g)��H2O(g)����H��0
CH2===CH2(g)��H2O(g)����H��0
C. 2C6H5CH2CH3(g)��O2(g) ![]() 2C6H5CH===CH2(g)��2H2O(g)����H��0
2C6H5CH===CH2(g)��2H2O(g)����H��0
D. CO2(g)��2NH3(g) ![]() CO(NH2)2(s)��H2O(g)����H��0
CO(NH2)2(s)��H2O(g)����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ�õ�صĹ���ԭ��ʾ��ͼ���õ�صĵ缫�����һ��ϸС�IJ��ۣ��������������ǿ�������ȶ�����ش�
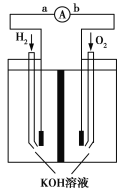
��1������ȼ�ϵ�طŵ�ʱ����ת����ʽ��Ҫ��__________���ڵ����е�����������Ϊ________(��a.b��ʾ)��
��2��������ӦʽΪ__________________��
��3���缫����Ʋ��۵�ԭ��Ϊ__________________��
��4���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��.Li��H2![]() 2LiH
2LiH
��.LiH��H2O===LiOH��H2��
����Ӧ���еĻ�ԭ����________����Ӧ���е���������____________��
��֪LiH������ܶ�Ϊ0.82 g/cm3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ________��
�����������ɵ�LiH��H2O���÷ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com