
A.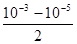 mol·L-1 mol·L-1 | B.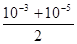 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.以上计算式都不对 |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.HX一定是弱酸 | B.NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C.HX一定是强酸 | D.反应过程中二者生成H2的速率相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
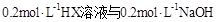 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是A.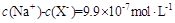 |
B.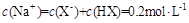 |
C.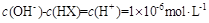 |
D.混合溶液中由水电离出的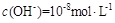 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸溶液的导电性比盐酸溶液的弱 |
| B.0.1mol/L乙酸钠溶液的pH约为8 |
| C.把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 |
| D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰9 | B.9︰1 | C.1︰11 | D.11︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液加入等体积pH=4的盐酸,则混合液pH=7 |
| B.pH相等的硫酸、盐酸、醋酸,都稀释1000倍,稀释后pH最大的是醋酸 |
| C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7 |
| D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙两溶液的pH不可能相同 |
| B.甲、乙两种溶液中加入Al粉都一定会产生H2 |
| C.HCO3-不可能在甲、乙两溶液中大量共存 |
| D.甲不可能是盐溶液,乙不可能是酸或碱溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com