
����Ŀ���ܣ�Co��������������Ԫ�ء����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�á���ش��������⣺
��1��Co��̬ԭ�ӵļ۵����Ų�ͼΪ______��
��2��̪ݼ�ܽ������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�Ʒ��еĹ������������ȷ���õ��˹㷺��Ӧ�á���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
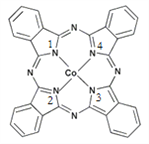
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ��______������Ӧ��Ԫ�ط������𣩣�̼ԭ�ӵ��ӻ��������Ϊ______��
����������ͨ����λ����ϵĵ�ԭ�ӵı����______��
��3��CoCl2�нᾧˮ��Ŀ��ͬ���ֲ�ͬ����ɫ��
![]()
CoCl2�����ӵ��轺��һ�ָ��������ɺ����������ʹ�ã����Ƴɱ�ɫ�轺�������轺������CoCl2������________��
��4����KCN������Co2+������Һ���к�ɫ��Co(CN)2�������������ڹ�����KCN��Һ��������ɫ��[Co(CN)6]4-���������Ӿ���ǿ��ԭ�ԣ��ڼ���ʱ����ˮ��Ӧ���ɵ���ɫ[Co(CN)6]3-��д���÷�Ӧ�����ӷ���ʽ��________��
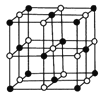
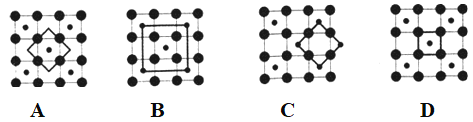
��5��Co��һ��������ľ�������ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����_________�����������Ͽ�ѧ����ʵ���ҵ�һ������С�鷢������ 5K �³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ��ɵ���________��
���𰸡� ![]() N>C>H sp2 2��4 ���Ź轺����ʪ���ٴκ�ɣ����Ȼ����ڽᾧˮ�������ˮ�μ�ת����ͨ����ɫ�ı仯���Ա����轺����ʪ�̶� 2[Co(CN)6]4-+2H2O
N>C>H sp2 2��4 ���Ź轺����ʪ���ٴκ�ɣ����Ȼ����ڽᾧˮ�������ˮ�μ�ת����ͨ����ɫ�ı仯���Ա����轺����ʪ�̶� 2[Co(CN)6]4-+2H2O![]() 2[Co(CN)6]3-+H2��+2OH�C 12 D
2[Co(CN)6]3-+H2��+2OH�C 12 D
��������(1)CoΪ27��Ԫ�أ�ԭ�Ӻ��������Ϊ27�������������ԭ�������������Ų�ʽΪ��1s22s22p63s23p63d74s2���۵����Ų�ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)��̪ݼ�������ַǽ���ԭ��ΪC��N��H��ͬ����������ҵ縺�����ǽ�����Խǿ�縺��Խ�ʵ縺��N��C��H��������Cԭ�Ӿ��γ�3��������û�й¶Ե��ӣ��ӻ������ĿΪ3��̼ԭ�ӵ��ӻ��������Ϊ sp2���ʴ�Ϊ��N��C��H��sp2��
�ں��й¶Ե��ӵ�Nԭ����Coͨ����λ����ϣ��γ���λ�����γ�4�Թ��õ��Ӷԣ��γ�3�Թ��õ��ӶԵ�Nԭ���γ���ͨ�Ĺ��ۼ���1�š�3��Nԭ���γ�3�Թ��õ��Ӷ�Ϊ��ͨ���ۼ���2�š�4��Nԭ���γ�4�Թ��õ��Ӷԣ���Coͨ����λ����ϣ��ʴ�Ϊ��2��4��
(3)���Ź轺����ʪ���ٴκ�ɣ����Ȼ����ڽᾧˮ�������ˮ�μ�ת����ͨ����ɫ�ı仯���Ա����轺����ʪ�̶ȣ��ʴ�Ϊ�����Ź轺����ʪ���ٴκ�ɣ����Ȼ����ڽᾧˮ�������ˮ�μ�ת����ͨ����ɫ�ı仯���Ա����轺����ʪ�̶ȣ�
(4)[Co(CN)6]4-�����Ӿ���ǿ��ԭ�ԣ��ڼ���ʱ����ˮ��Ӧ���ɵ���ɫ[Co(CN)6]3-��ֻ����ˮ����Ԫ�ر���ԭΪ���������ݵ���غ����������������ɣ��÷�Ӧ���ӷ���ʽΪ��2[Co(CN)6]4-+2H2O![]() 2[Co(CN)6]3-+H2��+2OH -���ʴ�Ϊ��2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2��+2OH -���ʴ�Ϊ��2[Co(CN)6]4-+2H2O![]() 2[Co(CN)6]3-+H2��+2OH -��
2[Co(CN)6]3-+H2��+2OH -��
(5)�������ᄃ���ṹ��֪������Co��Oԭ����Ŀ֮��Ϊ1��2�������ɫ��ΪCoԭ�ӣ��Զ���Coԭ��Ϊ�о�������֮�Ⱦ������������ԭ��λ�����ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã��ڸþ�������һ����ԭ�ӵȾ������������ԭ����ĿΪ![]() =12��CoO2���ظ��ṹ��Ԫʾ��ͼ��Co��Oԭ����Ŀ֮��ӦΪ1��2����ͼ���֪��
=12��CoO2���ظ��ṹ��Ԫʾ��ͼ��Co��Oԭ����Ŀ֮��ӦΪ1��2����ͼ���֪��
A��Co��Oԭ����Ŀ֮��Ϊ1��4��![]() =1��2�����ϣ�B��Co��Oԭ����Ŀ֮��Ϊ(1+4��
=1��2�����ϣ�B��Co��Oԭ����Ŀ֮��Ϊ(1+4��![]() )��4=1��2�����ϣ�C��Co��Oԭ����Ŀ֮��Ϊ4��
)��4=1��2�����ϣ�C��Co��Oԭ����Ŀ֮��Ϊ4��![]() ��4��
��4��![]() =1��2�����ϣ�D��Co��Oԭ����Ŀ֮��Ϊ1��4��
=1��2�����ϣ�D��Co��Oԭ����Ŀ֮��Ϊ1��4��![]() =1��1�������ϣ��ʴ�Ϊ��12��D��
=1��1�������ϣ��ʴ�Ϊ��12��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���ĸ�ԭ���װ�ã����н�����ȷ����(����)

A. �٢���Mg��Ϊ�������ۢ���Fe��Ϊ����
B. ����Mg��Ϊ�������缫��ӦʽΪ6H2O��6e��===6OH����3H2��
C. ����Fe��Ϊ�������缫��ӦʽΪFe��2e��===Fe2��
D. ����Cu��Ϊ�������缫��ӦʽΪ2H����2e��===H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.�����ЧӦ�����ڼ��������Һ
B.�������ӵ�ֱ����1��100 nm֮��
C.����һ���ǻ����
D.��FeCl3ϡ��Һ������ˮ�����Ƶ�Fe��OH��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Aԭ�ӵ�L���Ӳ��Ԫ��Bԭ�ӵ�L���Ӳ��� 3�����ӣ�BԪ��ԭ�Ӻ������������AԪ��ԭ�Ӻ������������5������A��B�γɵĻ�����Ļ�ѧʽ����Ϊ(����)
A.B2A3B.B3A2
C.A2B3D.BA2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ӧ������ͼ��ʾ�ķ����о����ʵ����ʣ���������A����Ҫ�ɷ��������������ǿ�����ˮ�������ش��������⣺
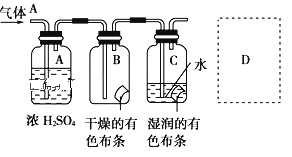
(1)�����о�(ʵ��)����ҪĿ����__________________________________��
(2)ŨH2SO4�������� _______________________�����о�Ŀ��ֱ����ص�ʵ��������___________________��
(3)���������ʵķ���������������ʵ����ƻ����ڲ���֮��������������������Ϊ__________________������D����ͼ����ʽ�����˷������Ĵ�ʩ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�п��ܺ���Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�

����������Ϣ���ش��������⣺
��1����������������ʵ�鲻��ȷ����ҺX���Ƿ��е����������ӷֱ��� ����֤�����������Ƿ���ڵļ�ʵ�����Ϊ____ __��
��2�������ӷ��̱������з�Ӧ��
������������A�� ������������ҺH�� ��
��3��������������������Ũ��Ϊ2mol/L��������l0mlʱ��ʼ����������55mlʱ���������ﵽ���ֵ0.03mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60mlʱ����������Ϊ0.025mol�ұ��ֲ��䣬��ԭ��Һ��c��Fe2+��Ϊ mol/L��c��Fe3+��Ϊ mol/L��c��Cl����Ϊ mol/L��������Щ���Ӳ����ڣ�����0mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��W��5�ֶ�����Ԫ�أ�ԭ�����������������ǿ�������ӻ�����Z2Y���ۻ�����RY3��XW4����֪Y��Rͬ���壬 Z��R ��Wͬ���ڡ�����˵���������( )
A. ԭ�Ӱ뾶��Z��R��W
B. ��̬�⻯���ȶ��ԣ�HmW��HnR
C. XW4�����и�ԭ�Ӿ�����8���ӽṹ
D. Y��Z��R����Ԫ����ɵĻ�����ˮ��Һһ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��ʱAgCl��Ksp��4��10��10������˵������ȷ����

A. ��t��ʱ��AgBr��KspΪ4.9��10��13
B. ��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C. ͼ��a���Ӧ����AgBr�IJ�������Һ
D. ��t��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)ƽ�ⳣ��K��816
AgBr(s)��Cl��(aq)ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com