
【题目】氨气常用作合成氯氨类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NCl3),副产物少于其它水消毒剂。
回答下列问题:
(1)工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=___kJ/mol。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生完全水解,生成具有强烈杀菌消毒作用的物质,该水解反应的化学方程式为___。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
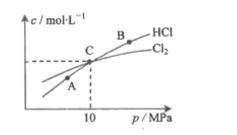
①A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C")。
②计算C点时该反应的压强平衡常数Kp(C)=____(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图),总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
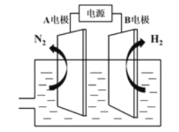
①A电极连接电源的___极(填"正”或“负”)。
②A电极的电极反应为___。
【答案】+11.3kJ/mol NH2Cl+H2O=NH3+HClO B 3 正 CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+
【解析】
(1)△H等于反应物的总键能减去生成物的总键能;一氯胺的水解属于两物质之间交换成分的复分解反应,据此可写化学方程式;
(2)①Cl2转化率最高点就是图中Cl2含量最低、HCl含量最高的点;
②要计算C点时该反应的压强平衡常数Kp(C),按起始物质的量,用三段式计算出平衡时各成分的物质的量,再按信息计算(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
(3)按电解总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,所连就是的电源正极,A电极上就是尿素被氧化的反应;
3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,所连就是的电源正极,A电极上就是尿素被氧化的反应;
(1)△H等于反应物的总键能减去生成物的总键能;对于反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g),△H=243.0+3×391.3-(2×391.3+191.2+431.8)=+11.3kJ/mol
答案为:+11.3kJ/mol;
一氯胺的水解属于两物质之间交换成分的复分解反应,则化学方程式为NH2Cl+H2O=NH3+HClO;
答案为:NH2Cl+H2O=NH3+HClO;
(2)①Cl2转化率最高点就是图中Cl2含量最低、HCl含量最高的B点;
答案为:B;
②计算C点时反应2Cl2(g)+NH3(g) ![]() NHCl2(g)+2HCl(g)的压强平衡常数Kp(C),
NHCl2(g)+2HCl(g)的压强平衡常数Kp(C),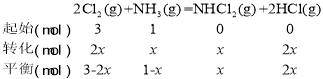
因为C点氯气和氯化氢等量,所以3-2x=2x,x=0.75mol,气体总物质的量为3-2x+1-x+x +2x=4mol,总压强为10MPa,按定义计算Kp,![]()
 =3
=3
答案为:3;
(3)按电解总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,A所连就是的电源正极,
3H2↑+N2↑+CO2↑分析,尿素是还原剂被氧化,它发生反应的A电极就是阳极,A所连就是的电源正极,
答案为:正;
A电极上就是尿素被氧化的反应;由图知,氧化产物为N2,则电极反应式为:CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+;
答案为:CO(NH2)2-6e-+H2O=CO2↑+N2↑+6H+。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O![]() CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是
CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是

A. 图中A、B两点表示的c(CH3COOC2H5)相等
B. 反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
C. 图中t0时说明反应达到平衡状态
D. 图中tB时CH3COOC2H5的转化率等于tA时的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.澄清石灰水与过量的小苏打溶液反应:![]()
B.往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀: A13++2SO42-+2Ba2++3OH-![]() A1(OH)3↓+2BaSO4↓
A1(OH)3↓+2BaSO4↓
C.向NaHSO4溶液中滴加![]() 至刚好沉淀完全:
至刚好沉淀完全:![]() ↓
↓![]()
D.向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2I— +Cl2![]() I2+2Cl--
I2+2Cl--
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
C. 25 ℃时,该反应的平衡常数K=2.2
D. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
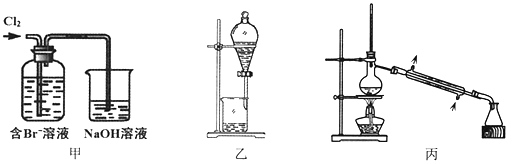
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
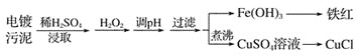
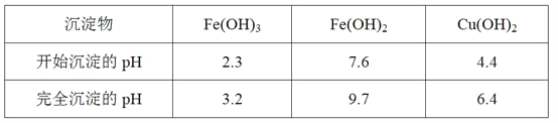
(1)酸浸后加入H2O2的目的是__,调pH的最适宜范围为__。
(2)调pH过程中加入的试剂最好是__。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
(3)煮沸CuSO4溶液的原因是__。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式__。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是__。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol﹒L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol﹒L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
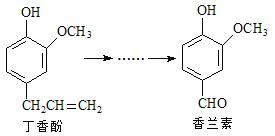
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )
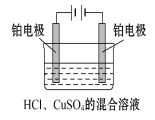
A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是
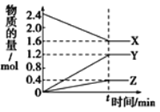
A. 反应的化学方程式为2X=3Y+Z
B. 若t=4,则0~t的X的化学反应速率为0.1mol·L-1·min-1
C. t时,正、逆反应都不再继续进行,反应达到平衡状态
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com