
����Ŀ�������飨As)���ǵ�VA��Ԫ��, �������֪ʶ�ش��������⣺
(1)��֪���� 2O2(g) + N2(g)=N2O4(l) ��H1
�� N2(g)+2H2(g)=N2H4(l) ��H2
��O2(g)+2H2(g)=2H2O(g) ��H3
��2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H4=-1048.9kJ/mol
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4=______��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ_______��
(2)����Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ơ���д�������������γɵ������εĻ�ѧʽ_______��
(3)������һ�ֳ��õĻ�ԭ���������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������lkg�������ɴ���_______Lˮ������ˮ���ܽ�O2��Ϊ10mg/L��
(4)������Ȼ������Ҫ��������ʽ�����ۻ�As4S4���ƻ�As2S3�ȣ����ڡ��ƻƿɱ�Ũ��������ΪH3AsO4��S,���ᱻ��ԭΪNO2,��Ӧ���������뻹ԭ�����ʵ���֮��Ϊ____________��
���𰸡� 2��H3-2��H2-��H1 ��Ӧ���ȶࡢ������������ N2H6(HSO4)2 ��N2H6SO4 ��(N2H5)2SO4 1��105 10:1
��������(1)��2O2(g)+N2(g)�TN2O4(l)��H1����N2(g)+2H2(g)�TN2H4(l)��H2����O2(g)+2H2(g)�T2H2O(g)��H3�������Ȼ�ѧ����ʽ��˹���ɣ�������2-����2-�ٵõ��ܣ�2N2H4(l)+N2O4(l)�T3N2(g)+4H2O(g)��H4=2��H3-2��H2-��H1�����ݷ�Ӧ�ܿ�֪��������N2O4��Ӧ�ų��������Ҳ����������壬��˿���Ϊ����ƽ������ʴ�Ϊ��2��H3-2��H2-��H1����Ӧ�����������������壻
(2)����Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백������������һ�����뷽��ʽΪN2H4+H2ON2H5++OH-���ڶ������뷽��ʽΪN2H5++H2ON2H62++OH-����������������γɵ�����N2H6(HSO4)2�� N2H6SO4��(N2H5)2SO4���ʴ�Ϊ��N2H6(HSO4)2�� N2H6SO4��(N2H5)2SO4��
(3)������һ�ֳ��õĻ�ԭ���������ڴ�����ѹ��¯ˮ�е���������������ʧ����N2H4��N2ʧȥ4e-��O2��O2-�õ�4e-��������������Ħ����������32g/mol����������������������ʵ�����ͬ��������1kg�������ɳ�ȥˮ���ܽ��O21kg�����Դ���ˮ�����Ϊ�� ![]() =1��105L���ʴ�Ϊ��1��105��
=1��105L���ʴ�Ϊ��1��105��
(4)1molAs2S3������ΪH3AsO4��Sʱת�Ƶ�����Ϊ[(5-3)��2+2��3]mol=10mol��1mol���ᱻ��ԭΪNO2ʱת�Ƶ���Ϊ(5-4)mol=1mol�����ݵ�ʧ�����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ10��1���ʴ�Ϊ��10��1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ᷴӦ��������NaOH��Һ��Ӧ����
��Na2SiO3����Al(OH)3����NH4HCO3����Al2O3����NaHSO4
A.�٢ڢ�B.�ڢۢ�C.�ڢܢ�D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����а�����100�������а�������Ϊ102�����Ȼ�����Ϊ101����������Щ������ϳɵĺ���2�������ĵ������У�������ԭ�ӵ���Ŀ�ǣ� ��
A. 101 B. 102 C. 103 D. 104
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҡ����������졢�����������ڱ��е����λ����ͼ���ײ�һ���ڶ������������ϣ����졢���ֱ��ǿ������ؿ��к�������Ԫ�أ������ж���ȷ���ǣ� �� 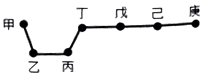
A.��һ���ǽ���Ԫ��
B.��̬�⻯����ȶ��ԣ�����������
C.�ҡ������������������ˮ������������Ӧ
D.�������������ˮ����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�������� ��
A. �����ĸ�ʴ�л�ѧ��ʴ�͵绯ѧ��ʴ
B. ��֬������������ˮ��ķ�Ӧ�ֽ�������Ӧ
C. �����������࣬�Ǹ߷��ӻ�����
D. ҽ�þƾ���ʹ�����ʱ��ԣ�������ҽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ÿ������ķϾ�Ǧ����Լ330��֣��Ӻ�Ǧ���ϣ�PbSO4��PbO2��PbO�ȣ��л���Ǧ��ʵ��Ǧ�������������ش�һ�ֻ���Ǧ�Ĺ����������£�

(1)Ǧ���طŵ�ʱ��PbO2��_______����
(2)���� I ,��֪��PbSO4��PbCO3 ���ܽ�ȣ�20��)��ͼ 1; Na2SO4��Na2CO3�� �ܽ�ȼ�ͼ2��

�ٸ���ͼ1д������I�����ӷ���ʽ��_____________��
�����������е��¶�Ӧ������40�������¶Ƚ��ͣ�PbSO4��ת�������½�������ͼ2������ԭ��
i.�¶Ƚ��ͣ���Ӧ���ʽ��ͣ�
ii._______________(�������һ�ֺ������ͣ���
(3)���� II��������Ӧ 2PbO2 + H2C2O4=2PbO + H2O2 + 2CO2����PbO�� Al2O3�������ƣ�PbO������������Һ��Ӧ�����ӷ���ʽ��________________��
(4)������,��PbO��Ʒ�ܽ���H2SO4��NaCl�Ļ����Һ�У��õ���Na2PbCl4�ĵ��Һ�����Na2PbCl4��Һ������Pb,����ͼ��

�������ĵ缫��Ӧʽ��____________��
�ڵ��һ��ʱ���Na2PbCl4Ũ�ȼ����½���Ϊ�˻ָ���Ũ����ʵ�����ʵ�ѭ�����ã���������ȡ�ķ�����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ʵ������ȡ�����װ�ã����ڷ�����������ռ����塣���и�������������������װ�ý���ʵ�����
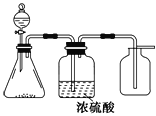
A����ȡNO���� B����ȡ������̼����
C����ȡ���� D����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����̼������ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��a��b��Ϊ���Ե缫������������ȷ����(����)

A. a�缫������ԭ��Ӧ��b�缫����������Ӧ
B. �����ֵ������Դ����ͭ����������������6.4 g�����������ı�״���µ�CO 2.24 L
C. A��ͨ����ǿ�����B��ͨ�����CO
D. a�缫�ĵ缫��ӦʽΪCO��4OH����2e��===CO2��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���ˮ�еμ�FeCl3��Һ�Ʊ�Fe��OH��3���壺Fe3++3H2O ![]() Fe��OH��3��+3H+
Fe��OH��3��+3H+
B.��С�մ�����θ����ࣺNaHCO3��+H+=Na++CO2��+H2O
C.ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2+4H++2Cl�� ![]() Cl2��+Mn2++2H2O
Cl2��+Mn2++2H2O
D.��FeCl3��Һ��ʴӡˢ��·�壺Fe3++Cu=Fe2++Cu2+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com