
【题目】电解普通水和重水(![]() H2O)的混合物,通电一段时间后,两极共生成气体18.5g,体积为33.6L(标况下)。求所生成的气体中氕和氘的原子个数比是多少。
H2O)的混合物,通电一段时间后,两极共生成气体18.5g,体积为33.6L(标况下)。求所生成的气体中氕和氘的原子个数比是多少。
【答案】3:1
【解析】试题分析:电解水的方程式为2H2O![]() 2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,33.6L混合气体中,气体的物质的量是n=33.6L÷22.4L/mol=1.5mol,其中氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的物质的量是0.5mol,氧气的质量m(O2)=(11.2L÷22.4L/mol)×32g/mol=16g;氢气的质量为2.5g,所以氢气的平均摩尔质量=2.5g÷1mol=2.5g/mol,普通氢和重氢的物质的量之比为:(4-2.5):(2.5-2)=1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1.
2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,33.6L混合气体中,气体的物质的量是n=33.6L÷22.4L/mol=1.5mol,其中氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的物质的量是0.5mol,氧气的质量m(O2)=(11.2L÷22.4L/mol)×32g/mol=16g;氢气的质量为2.5g,所以氢气的平均摩尔质量=2.5g÷1mol=2.5g/mol,普通氢和重氢的物质的量之比为:(4-2.5):(2.5-2)=1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1.


科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
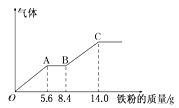
A. H2SO4浓度为2.5mol·L-1
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. 原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.甲烷在氧气中燃烧
C.灼热的炭与二氧化碳反应
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是
A.78 g Na2O2晶体中所含阴、阳离子个数为3NA
B.3.4 g氨气中含有0.6NA个N—H键
C.Na2O2的电子式为:![]()
D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱。实验装置如下,请根据要求回答下列问题:
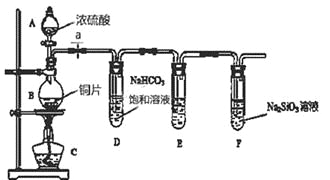
(1)填写所示仪器名称:A 。
(2)实验步骤:连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中盛足量酸性KMnO4溶液的作用是 。
②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是 。
③依据试管D中发生的反应,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
![]()
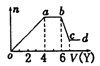
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是_________,
ab段发生反应的离子是________,bc段发生反应的离子方程式为________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是______________,其物质的量之比为________,
ab段反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活中有极其重要的作用。
(1)我国长征系列运载火箭用肼(N2H4)作燃料。N2H4与NH3有相似的化学性质。
①写出肼与盐酸反应的离子方程式:_______________。
②在火箭推进剂中装有液态肼和双氧水,当它们混合时迅速反应生成氮气和水蒸气,写出反应的化学方程式:______________。
③火箭发射时以肼为燃料,也可以用一氧化氮作氧化剂,在此反应过程中若转移2 mol电子,则消耗燃料肼的质量为__________。
(2)汽车尾气中的氮氧化物是形成酸雨、酸雾的有毒气体之一,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。写出净化过程中总反应的化学方程式:_______________。
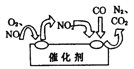
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com