
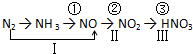
分析 (1)氮气的化学性质比较稳定,故可用氮气做保护气、保存粮食、制氨气等;
(2)实验室中用氢氧化钙和氯化铵加热反应制取氨气,写出该反应的化学方程式;
(3)工业制硝酸第③步为二氧化氮与水反应生成硝酸和一氧化氮;
(4)(ⅰ)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;所含元素化合价升高的物质发生氧化反应;氧化剂获得电子,发生还原反应,结合N元素化合价变化计算转移电子;
(ⅱ)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,这两部分硝酸的质量即为消耗的硝酸的质量;
(ⅲ)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平完成方程式,再改写成离子方程式.
解答 解:(1)由于氮气的化学性质比较稳定,焊接金属时可以用氮气做保护气,储存粮食时也可以用氮气代替空气,避免粮食变质,工业合成氨中以氮气为原料,
故答案为:做保护气(或保存粮食、制氨气等);
(2)实验室中用氢氧化钙与氯化铵加热反应生成氯化钙、氨气和水,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)工业制硝酸第③步反应为二氧化氮与水反应生成硝酸,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(4)(ⅰ)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
反应中Cu元素化合价升高,发生氧化反应,硝酸是氧化剂,获得电子,其化合价由+5降低为+4,故1mol硝酸完全其氧化剂作用,转移电子为1mol,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu;得到; 1;
(ⅱ)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,
n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,即被还原的硝酸的物质的量为1mol,
n(Cu)=$\frac{48g}{64g/mol}$=0.75mol,则生成n[Cu(NO3)2]=0.75mol,可知表现酸性的硝酸的物质的量为0.75mol×2=1.5mol,
则参加反应的硝酸的物质的量为:1.0mol+1.5mol=2.5mol,
故答案为:C;
(ⅲ) 所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,改写成离子方程式为:8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O,
故答案为:FeSO4;→Fe(NO3)3+Fe2(SO4)3;8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O.
点评 本题考查氧化还原反应基本概念、计算与配平及含氮化合物的综合应用等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,注意掌握氧化还原反应的配平方法,明确含氮化合物的知识及其应用.


科目:高中化学 来源: 题型:选择题
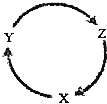 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Al(OH)3 | AlCl3 | Al2O3 |
| C | SiO2 | Na2SiO3 | H2SiO3 |
| D | NH3 | NH4Cl | NH4NO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
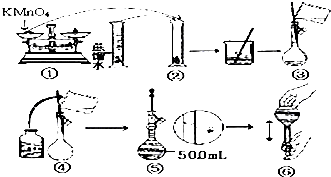 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液和明矾的水溶液 | B. | Na2CO3溶液和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | 盐酸和NaAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用二氧化硅在高温下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 | |
| B. | 手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 | |
| C. | 2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 | |
| D. | 白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成有香味的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L | |
| C. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1mol Zn,转移的电子总数等于2NA | |
| D. | 5.4g Al分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com