
 实验室制取乙炔的实验装置图(如图)中,
实验室制取乙炔的实验装置图(如图)中,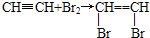 ,
, ;
;

科目:高中化学 来源: 题型:
135 53 |
135 53 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 多核 | 单核 | 双核 | 多核 | 多核 |
| 所带单位电荷 | 1+ | 2- | 0 | 1- | 1- | 0 | 1+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.查看答案和解析>>
科目:高中化学 来源: 题型:
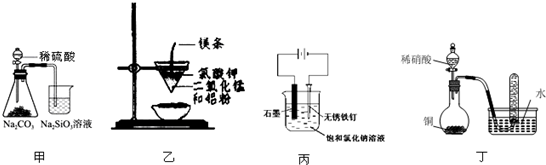
| A、用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B、用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C、用丙装置可实现对铁钉的保护 |
| D、用丁装置验证铜与稀硝酸反应的气体产物只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 | 解释 | |
| A | 100℃0.1mol/L Na2SO4溶液pH=6.2 | H2O?H++OH- |
| B | 0.1mol/L CH3COOH的pH=3 | CH3COOH?CH3COO-+H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH-?Fe(OH)3 |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com