
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液中存在大量氢离子,pH=14的溶液中存在大量氢氧根离子,
A.偏铝酸根离子与氢离子反应;
B.钙离子与硫酸根离子反应生成微溶物硫酸钙;
C.四种离子之间不反应,都不与氢离子、氢氧根离子反应,且为无色溶液;
D.高锰酸根离子为有色离子.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液中存在大量氢离子,pH=14的溶液中存在大量氢氧根离子,
A.AlO2-与氢离子反应,在pH=0的溶液中不能大量共存,故A错误;
B.Ca2+、SO42-之间反应生成硫酸钙,在溶液中不能大量共存,故B错误;
C.Na+ K+ SO42- NO3-之间不反应,都不与氢离子、氢氧根离子反应,且为无色溶液,在溶液中能够大量共存,故C正确;
D.MnO4-为有色离子,不满足溶液无色的条件,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
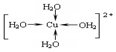 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
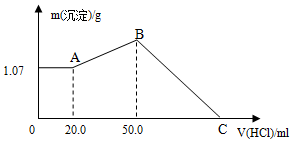 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
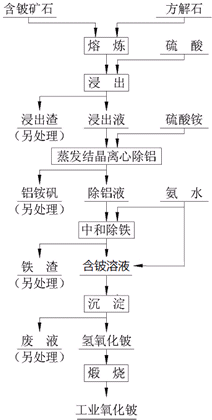 硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com