
| A、①⑤⑥⑦ | B、①②③⑤ |
| C、②④⑤⑥ | D、以上全部 |


科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:| 1000Vd |
| 36.5V+2240 |
| Vd |
| 36.5V+2240 |
| 1000d |
| 36.5V+22.4 |
| 36.5V |
| 22.4(V+1)d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 |
| B、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO+Ca2++2OH-═CaCO3↓+CO+2H2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2═2Na2CO3+O2 |
| D、向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
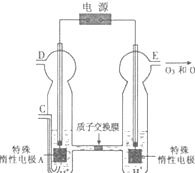 O3可由臭氧发生器(原理如图)电解稀硫酸制得.
O3可由臭氧发生器(原理如图)电解稀硫酸制得.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L SO3中所含有分子数为NA |
| B、常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA |
| C、在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA |
| D、1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、①②③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石墨烯属于有机物 |
| B、该材料吸油过程为物理变化 |
| C、碳纳米管是碳的一种同位素 |
| D、碳纳米管属于胶体分散系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com