
【题目】部分弱酸的电离平衡常数如下表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项正确的是( )
A.2CN-+H2O+CO2===2HCN+CO![]()
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH![]() )相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
科目:高中化学 来源: 题型:
【题目】化学在人类生活中扮演着重要角色,下列说法正确的是( )
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.气象环境报告中新增的“PM2.5”是对一种新分子的描述
C.将水坝的钢铁闸门与直流电的负极相连可以防闸门腐蚀
D.煤的干馏可以得到苯、甲苯等烃,不能得到衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于________(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是________。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是________。

a. 可以溶于盐酸
b. 相比纯金币,熔点高
c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和________。
②以上营养成分中________是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有________性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①下列措施中,不能减少雾霾的是________(填字母)。
a. 禁止焚烧秸秆、树叶
b. 优选公交出行,减少汽车尾气排放
c. 提倡火力发电,提高燃煤使用量
室内装修中使用不合格大理石可能会释放放射性气体________。
②下列污水处理的方法只涉及到物理变化的是________(填字母)。
a. 活性炭吸附法 b. 化学沉淀法 c. 中和法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为_______________________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是________。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于________电池(选填“一次”或“二次”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏
B.升华
C.干馏
D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( 15 分)
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
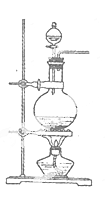
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3) = 2.8×10-9、Ksp(MnCO3) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
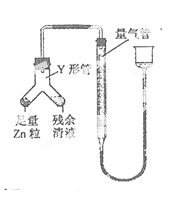
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:
Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
Ca2+(aq)+2OH-(aq),当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
A. 溶液中Ca2+数目不变 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1 B.它们的氧原子数目之比为 2∶3
C.它们的体积之比是 1∶1 D.它们的密度之比为 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
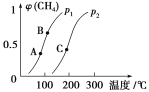
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
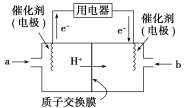
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com