

科目:高中化学 来源: 题型:
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
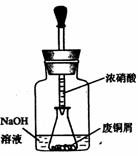
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
 完成下列填空:
完成下列填空:
35.写出浓硝酸与铜反应的离子方程式。
36.上图装置中NaOH溶液的作用是__。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
37.步骤二中,水浴加热所需仪器有____、__(加热、夹持仪器、石棉网除外);洗涤的目的是____。
38.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
39.影响产品产量的主要因素有____。
40.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
查看答案和解析>>
科目:高中化学 来源:2013届江西省上饶市横峰中学高三第一次月考化学试卷(带解析) 题型:实验题
(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜:如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。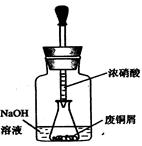
步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市杨浦区高三上学期期中考试化学试卷(解析版) 题型:实验题
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。

步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式: 。
(2)上图装置中NaOH溶液的作用是_ 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有___ _(填写化学式)。
(3)步骤二中,水浴加热所需仪器有__ _、_ (加热、夹持仪器、石棉网除外);
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法:
(5)影响产品产量的主要因素有__ __。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是___ _。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省上饶市高三第一次月考化学试卷(解析版) 题型:实验题
(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜: 如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。

步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
查看答案和解析>>
科目:高中化学 来源:2010年重庆市高三上学期第一次月考(理综)化学部分 题型:填空题
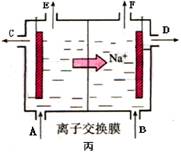
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
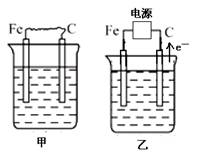
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com