
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A.①②③④B.⑤⑥⑦C.③⑤⑥⑦D.③④⑤⑥⑦
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A. 氧化还原反应前后元素化合价有升降
B. 氧化还原反应前后一定有氧的得失
C. 实现Fe3+→Fe2+的变化过程一定是氧化反应
D. 元素化合价升高的反应是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读以下信息:①向盛有10mL水的锥形瓶中,小心滴加8~10滴![]() 液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的
液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的![]() ;②蒸干
;②蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,使
,使![]() 与
与![]() 混合并加热,可得到无水
混合并加热,可得到无水![]() 。请回答:
。请回答:
(1)将①中发生反应的化学方程式补充完整:SOCl2+H2O=SO2↑+______;
(2)![]() 溶液呈________(填“酸”“碱”或“中”)性,用离子方程式表示其原理为:_________。
溶液呈________(填“酸”“碱”或“中”)性,用离子方程式表示其原理为:_________。
(3)试解释②中可得到无水![]() 的原因:_________。
的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现要测定某氯化铁与氯化亚铁混合物中铁元素的质量分数。实验按以下步骤进行:
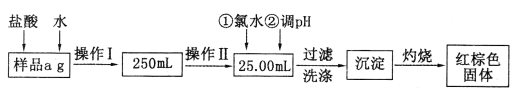
I.根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______(填仪器名称)。
(2)加入氯水发生反应的离子方程式为______________________________。
(3)将沉淀物灼烧后,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温,称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是___________________;若坩埚质量是w1g,坩埚与灼烧后固体总质量是w2g,则样品中铁元素的质量分数是_______________。
II.有同学提出,还可以采用以下方法来测定:
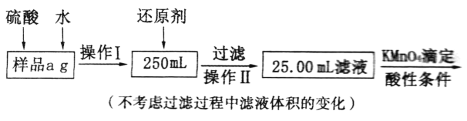
(4)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________________。
(5)选择的还原剂是否能用铁_____(填“是”或“否”),原因是______________________。
(6))若滴定消耗c mol· L-1KMnO4溶液b mL,则样品中铁元素的质量分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)NaOH的电子式_______________;二氧化碳的电子式___________________.
Ⅱ.下列物质: ①N2②H2O2③NH3④MgCl2⑤NaOH
(2)含有极性键和非极性键的物质是______(填序号,下同);含有极性键的离子化合物是________
Ⅲ.下列物质:①1H,2H,3H②H2O,D2O,T2O③O2,O3④14N,14C
(3)互为同位素的是________(填序号,下同);
(4)互为同素异形体的是__________
Ⅳ、写出以下反应的化学方程式
(5)甲烷燃烧______________
(6)乙烯和溴水_____________
(7)乙醇的催化氧化_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同系物的是
A. CH3CH2CH2CH3和CH(CH3)3 B. ![]()
C. ![]() 和
和![]() D. CH2=CH—CH=CH2和CH2=CHCH3
D. CH2=CH—CH=CH2和CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A. 2v (NH3)=v (CO2)
B. 密闭容器中气体密度不变
C. 密闭容器中混合气体的平均摩尔质量不变
D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com