
下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
科目:高中化学 来源: 题型:
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________;X与氢元素形成的化合物的电子式是_____________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________ ________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________________________________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
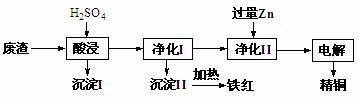
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO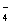 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛热。合成原理是:
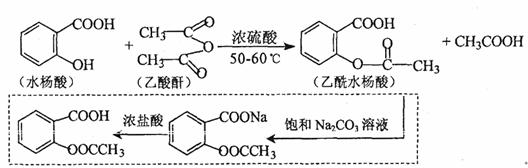
(1)水杨酸中含氧官能团的名称是 ,有关水杨酸的说法,正确的是 。
A.遇 FeCl3溶液可能显紫色 B.可发生酯化反应和水解反应
C.能与溴水发生取代反应和加成反应 D.1mol水杨酸最多能与3molH2发生加成反应
(2)水杨酸与乙酸酐反应的反应类型是 。
(3)乙酰水杨酸的分子式为 ,1mol乙酰水杨酸最多能与 molNaOH反应。
(4)虚框中为提纯,是为了除去该反应的副产物:水杨酸、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等,请写出乙酰水杨酸粗品中加入饱和Na2CO3溶液发生的主要化学反应方程式为:
。
(5)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显紫色 Ⅱ.苯环上只有一种一溴取代物
Ⅲ.能发生银镜反应 Ⅳ. 1mol该化合物能分别与1molNaOH和2mol金属钠反应
(6)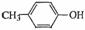 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生反应
O2(g)+2NO(g) 2 NO2(g) ,反应已达到平衡的标志是
2 NO2(g) ,反应已达到平衡的标志是
A.反应混合物中各组分的浓度相等
B.混合气体的密度不再改变
C.混合气体的颜色不再变化
D.O2 、NO、NO2三种物质的反应速率之比为1∶2 ∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
I.甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2(g)+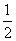 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH= 。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g) 的反应热ΔH= 。
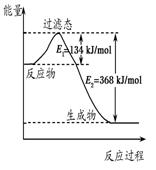
Ⅱ.(1)如右图是1 mol NO2(g)和1 mol CO(g)反应生成
CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 ,ΔH的变化是________(填“增大”、“减小”或“不变”)。
写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.K能层中不包含p能级 B.碳原子的电子排布式为1s22p4
C.3p3表示3p能级有三个轨道 D.同一原子中,2p、3p、4p能级的轨道数依次增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com