
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
分析 pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析.
解答 解:pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol•L-1,解得:c(OH-)=1×10-9mol•L-1,c(H+)=1×10-5mol•L-1pH=5,同理Fe(OH)3完全变成沉淀时,Ksp[Fe(OH)3]=1×10-39=c(Fe3+)×c3(OH-),c(OH-)=1×10-11mol•L-1,c(H+)=1×10-4mol•L-1,pH约为4,
故pH范围是:5.0<pH<7.1,
故选A.
点评 本题溶度积计算及混合物分离,为高频考点,侧重于学生的分析、计算能力的考查,本题注意把握溶度积的计算,题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | 2△H1-2△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
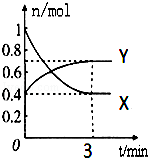 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com