
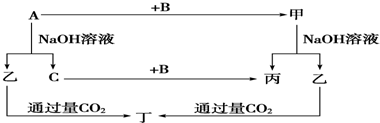
| 3.36L |
| 22.4L/mol |
| 2 |
| 3 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
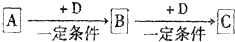 已知A、B、C是中学化学的常见物质,它们在一定条件下有如图所示转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如图所示转化关系:
| ||
| ||
| ||
| △ |
| ||
| △ |


| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
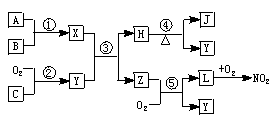
请根据以上材料,回答下列问题:
(1)用化学式表示化合物L_______、单质C______.
(2)物质Z的分子空间构型是______.
(3)反应①的化学方程式______.
(4)反应⑤的化学方程式______.
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论值偏_____(填“高”或“低”),其原因是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
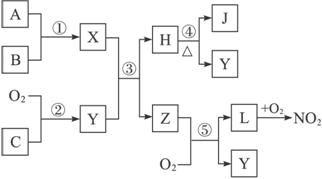
(1)用化学式表示化合物L:_____________,单质C:_____________。
(2)物质Z的分子空间结构是_____________。
(3)反应①的化学方程式为_____________________________________________。
(4)反应⑤的化学方程式为_____________________________________________。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论值偏(填“高”或“低”),其原因是____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com