
| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据相似相溶原理知,碘和四氯化碳都是非极性分子,水是极性分子,所以碘易溶于四氯化碳而不易溶于水;
B.亚铁离子和铁氰根离子发生络合反应生成蓝色沉淀;
C.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子;
D.重金属盐能使蛋白质发生变性.
解答 解:A.根据相似相溶原理知,碘和四氯化碳都是非极性分子,水是极性分子,所以碘易溶于四氯化碳而不易溶于水,向富碘的CCl4溶液中加入足量水、振荡、静置、分液,虽然碘在水中的溶解度低,但因为水的量大,导致碘溶于水中,但该实验不能说明碘易溶于水,故A错误;
B.亚铁离子和铁氰根离子发生络合反应生成蓝色沉淀,该实验现象及解释都正确,故B正确;
C.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子和NO,导致溶液颜色加深,与盐类水解无关,故C错误;
D.重金属盐能使蛋白质发生变性,硫酸铜属于重金属盐,使蛋白质发生变性,硫酸钠等盐溶液能使蛋白质发生盐析,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及蛋白质变性、硝酸的性质、亚铁离子检验等知识点,明确实验原理及物质性质是解本题关键,注意C中隐含条件的挖掘,为易错题.


科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:填空题
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
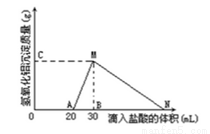
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
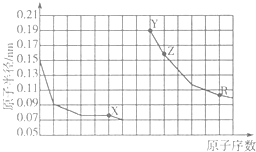
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
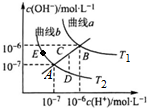
| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
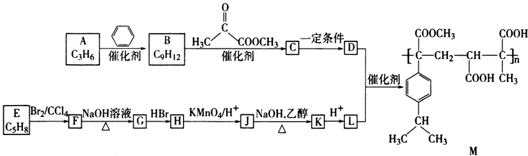
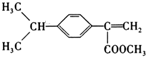 、
、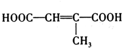 (写结构简式).
(写结构简式).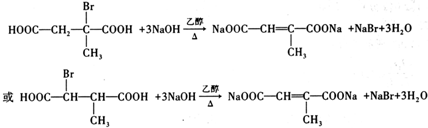 .
.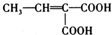 (写结构简式).
(写结构简式).查看答案和解析>>
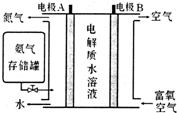
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
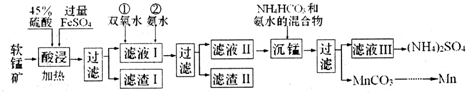
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com