
Ⅰ.经常有人因误食亚硝酸钠(NaNO2)而中毒,原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI=2NO + I2 + 2NaI + 2H2O
(1)HI 表现的性质是 (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
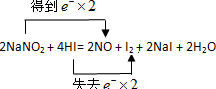
(2)用双线桥表示电子转移的方向和数目 。
(3)当此反应中转移的电子数为2.408×1023时,氧化产物物质的量为 。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 ,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做 。
③区分胶体和溶液常用的方法叫做 ,这是因为胶体粒子对光线的 作用而形成的。
Ⅰ.(1)B (2) (3)0.2mol
(3)0.2mol
Ⅱ.①饱和氯化铁溶液 溶液呈红褐色
FeCl3+3H2O(沸水)  Fe(OH)3(胶体)+3HCl ②SO42-
胶体的聚沉 ③丁达尔效应
散射
Fe(OH)3(胶体)+3HCl ②SO42-
胶体的聚沉 ③丁达尔效应
散射
【解析】
试题分析:Ⅰ.(1)在反应2NaNO2 + 4HI=2NO + I2 + 2NaI + 2H2O中,碘元素的化合价从-1价升高到0价,失去1个电子,被氧化,因此HI是还原剂。又因为同时还要NaI生成,因此HI还起到酸性的作用,所以答案选B。
(2)亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,因此亚硝酸钠是氧化剂,所以其电子转移的方向和数目可以表示为 。
。
(3)2.408×1023个电子的战斗力=2.408×1023÷6.02×1023/mol=0.4mol。根据以上分析可知,HI是还原剂,因此单质碘是氧化产物。每生成1mol单质碘反应中就转移2mol电子,所以当此反应中转移的电子数为2.408×1023时,氧化产物物质的量=0.4mol÷2=0.2mol。
Ⅱ. ①饱和FeCl3溶液呈黄色;向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即得到氢氧化铁胶体,反应的化学方程式为胶体加热能发生聚沉,产生沉淀,制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O(沸水) Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②由于Fe(OH)3胶粒带正电荷,加入硫酸钠溶液后,由于SO42-中和了胶粒所带的正电荷,从而使氢氧化铁胶体形成了沉淀,这个过程叫胶体的聚沉。
③由于胶体对光线有散射作用,从而可以形成丁达尔效应,但溶液不能产生丁达尔效应,据此可以区分溶液和胶体。
考点:考查氧化还原反应的有关判断、计算和表示;氢氧化铁胶体的制备、胶体的性质以及胶体与溶液的区分等


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江省金华一中高一上学期期中考试化学试卷 题型:单选题
经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知 亚硝酸钠能发生如下反应:2NaNO2 + 4HI=" 2NO" + I2 + 2NaI + 2H2O
亚硝酸钠能发生如下反应:2NaNO2 + 4HI=" 2NO" + I2 + 2NaI + 2H2O
(1)在此反应中,氧化剂是________(填化学式),氧化产物是___________(填化学式)。
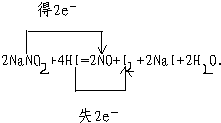
(2)用双线桥表示电子转移的情况__________________。
(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为____ ___。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江省高一上学期期中考试化学试卷 题型:选择题
经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI= 2NO + I2 + 2NaI + 2H2O
(1)在此反应中,氧化剂是________(填化学式),氧化产物是___________(填化学式)。
(2)用双线桥表示电子转移的情况__________________。
(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为____ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com