
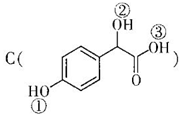
 中①、②、③3个-OH的酸性有强到弱的顺
中①、②、③3个-OH的酸性有强到弱的顺 

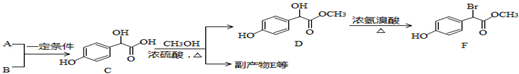
分析 A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为 ;D发生取代反应生成F;
;D发生取代反应生成F;
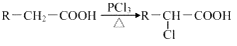
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH.
解答 解:A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为 ;D发生取代反应生成F;
;D发生取代反应生成F;
(1)A为OHC-COOH,A所含官能团名称为:醛基和羧基,故答案为:醛基和羧基;
(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基,故强弱顺序为:③>①>②,
故答案为:③>①>②;
(3)E的结构简式: ,故答案为:
,故答案为: ;
;
(4)D→F的反应类型是取代反应,F中酚羟基、酯基水解生成的羧基、溴原子被取代生成的HBr都能和NaOH反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol,
故答案为:取代反应;3;
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH,合成路线流程图为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH,
故答案为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH.
点评 本题考查有机物的推断与合成,为高考常见题型,侧重考查学生分析推断、知识综合运用及知识迁移能力,明确官能团及其性质关系、物质之间的转化是解本题关键,难点是有机合成路线设计,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代金银制品能保存至今是因为它们金属活动性强 | |
| B. | 铜器保存在潮湿的空气中不会生成铜绿 | |
| C. | 铝锅比较耐用,是因为铝锅表面有一层致密的氧化物薄膜 | |
| D. | 不锈钢制成的厨具不易生锈,是因为它不含铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com